微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:N2(g)+3H2(g) 2NH3(g)? ΔH<0;2SO2(g)+O2(g)
2NH3(g)? ΔH<0;2SO2(g)+O2(g) 2SO3(g)? ΔH<0;
2SO3(g)? ΔH<0;
回答下列问题:
(1)从影响速率和平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是_________________。实际生产中采取的措施分别是__________________。
(2)在实际生产的合成氨过程中,要分离出氨气,目的是____________________________;而合成SO3过程中,不需要分离出SO3,原因是__________________。
参考答案:(1)高温、高压、催化剂?合成氨:高温、高压、催化剂;合成SO3:高温、常压、催化剂?(2)减少生成物浓度,使平衡向生成NH3方向移动?该反应向生成SO3的方向进行程度大,达到平衡后SO2余量较少,故不需要分离SO3
本题解析:根据两个反应的特点:合成氨与二氧化硫的反应均是体积减小、放热的气体反应。所以从提高反应速率和增大反应物转化率来看:选择高温、高压、催化剂的条件均是合理的。但实际上,还要考虑设备的耐压能力、经济技术条件等因素,经过综合分析才能确定生产条件。
本题难度:简单
2、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3?MgO、CaO等,生产工艺流程示意如下:
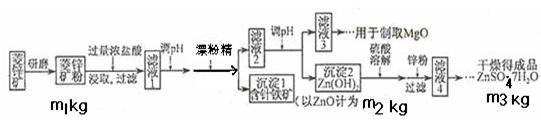
(1)将菱锌矿研磨成粉的目的是____?_,滤液1后两步操作的目是:?。
(2)完成加漂粉精反应的离子方程式:
□Fe(OH)2+□____+□_____ →□Fe(OH)3+□Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
??,?(用文字叙述)
(5) “滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
参考答案:(共12分,每小题2分)1)增大反应物接触面积或增大反应速率或使反应更充分,除去含铁杂质。
(2)2Fe(OH)2+ClO-+H2O? →2Fe(OH)3+Cl-
(3)FeO(OH)(或其它合理答案)
(4)Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH, Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH(任写两个即可)
(5)蒸发浓缩、冷却结晶(或其它合理答案)
(6)125m2/81m1(或其它合理答案)
本题解析:略
本题难度:一般
3、选择题 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是? ( )
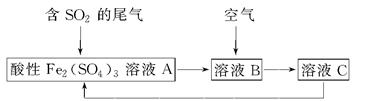
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
参考答案:D
本题解析:本题以综合处理SO2废气的工艺流程为载体,考查氧化还原反应的相关知识。结合题中流程可以分析得出其中涉及2个反应,依次为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+、4Fe2++O2+4H+=4Fe3++2H2O,故A错,同时由以上两个氧化还原反应方程式可知C错;用酸性高锰酸钾溶液只能检验溶液C中是否含有Fe2+,而不能检验Fe3+,B错。
本题难度:简单
4、选择题 某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工艺流程如下:
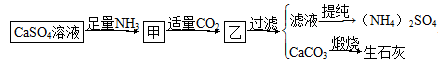
下列推断不合理的是? ( )。
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.在实际生产中CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
参考答案:D
本题解析:该反应原理为2NH3+CO2+H2O=(NH4)2CO3,CaSO4+(NH4)2CO3=CaCO3↓+(NH4)2SO4,CaCO3 CaO+CO2↑。直接蒸干会导致(NH4)2SO4分解。
CaO+CO2↑。直接蒸干会导致(NH4)2SO4分解。
本题难度:一般
5、选择题 下列说法正确的是
A.石油的炼制过程都是化学变化过程
B.石油分馏目的是将含碳原子数较多的烃先气化,后经冷凝而分离出来
C.石油经石油分馏、催化裂化等工序炼制后即能制得纯净物
D.石油分馏出来的各馏分仍是多种烃的混合物
参考答案:D
本题解析:石油分馏是物理变化,裂解和裂化才是化学变化,A不正确。B不正确,应该是含碳原子数少的烃先气化,因为碳原子数越少,沸点越低。C不正确,得到的还是混合物,石油正确的答案选D。
本题难度:简单