微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题

(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______? __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________?__;
A.c(N2)=c(H2)="c" (NH3)? B.容器内压强保持不变?
C.υ(N2)=3υ(H2)? D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体? B.适当升高温度
C. 增大压强? D.选择高效的催化剂
参考答案:(1)放热(1分) (2)0.75mol/(L·s) (2分) (3)B (1分) (4)C(1分)
本题解析:本题考查化学反应速率及化学平衡有关知识,关键在于明确化学反应速率的影响因素及化学平衡的判断。(1)450℃时NH3的浓度大于550℃时,说明温度升高,平衡向逆反应方向移动,则正反应是放热反应;(2)υ(H2)=3υ(N2)=3(2-1)/(2×2)= 0.75mol/(L·s);(3) A中浓度相等,但不一定达到平衡,只有浓度不在改变时,表示达到了平衡,该反应是体积不相等的反应,体积固定,故压强不变,表示该反应已达平衡;C项中未指明是正反应速率还是逆反应速率,故不能表示该反应已达平衡;体积固定,质量不变,密度不变,故不能表示该反应已达平衡;故选B。
(4)及时分离出NH3气体,减少生成物,减小逆反应速率,A不合题意;适当升高温度,平衡向逆反应方向移动,B不合题意;增大压强,反应速率增大,平衡向正反应方向移动,C合题意,正确;催化剂只改变反应速率,不影响平衡移动,D不合题意,故选C。
本题难度:一般
2、选择题 下列不需要用到二氧化硅的是
A.光导纤维
B.计算机芯片
C.石英钟表
D.玛瑙手镯
参考答案:B
本题解析:略
本题难度:一般
3、填空题 最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。
具体生产流程如下:
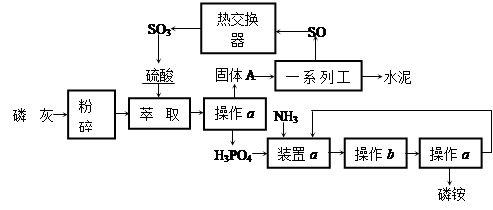
回答下列问题:
(1)操作a的名称是________,实验室中进行此操作的非玻璃仪器或用品有__________;在实验室中操作b的名称是________________________。
(2)装置a中生成两种酸式盐,它们的化学式分别是____________________________ 。
(3)依题意猜测固体A中一定含有的物质的化学式是__________(结晶水部分不写)。
(4)“热交换器”是利用“废热”预热_____________,除此之外还可利用硫酸工业的“废热”_________。
(5)SO3在______________(填设备名称)中用______________吸收转化为发烟硫酸。
参考答案:(1)过滤,铁架台(含铁圈)、滤纸,蒸发浓缩、冷却结晶;(2)NH4H2PO4? (NH4)2HPO4.
(3)CaSO4?(4)即将参与反应的SO2和O2?发电?(5)吸收塔? 98%的浓硫酸
本题解析:(1)分离难溶性固体与液体的方法是过滤。实验室中进行该操作的非玻璃仪器或用品有铁架(含铁圈)、滤纸。磷酸和氨气发生反应可以产生磷酸铵、磷酸氢二铵、磷酸二氢铵。。H3PO4+3NH3="(" NH4)3PO4.? H3PO4+2NH3=(NH4)2HPO4。H3PO4+NH3= NH4H2PO4。这些磷酸的铵盐都容易溶解于水。将其从溶液中分离出来。首先要将溶液蒸发、浓缩,然后冷却、结晶,最后过滤得到。(2)若装置a中生成两种酸式盐,则它们的化学式分别是NH4H2PO4、(NH4)2HPO4。(3)磷灰主要成分是磷酸钙。磷酸钙和硫酸发生反应产生磷酸和硫酸钙。所以猜测固体A中一定含有的物质是磷酸钙,化学式是CaSO4。(4)“热交换器”是利用“废热”预热即将参与反应的SO2和O2?,除此之外还可利用硫酸工业的“废热”发电。(5)SO3在吸收塔中被吸收的。由于水被浓硫酸吸收时容易形成酸雾,不利于三氧化硫的吸收。所以通常用98.3%的浓硫酸来吸收形成发烟硫酸。然后再用水稀释成需要的浓度。
本题难度:一般
4、填空题 右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
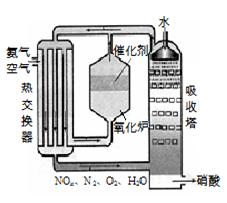
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l)? △H<0
4NO(g) +6H2O(l)? △H<0
②2NO(g)+O2 (g) 2NO2(g)? △H<0
2NO2(g)? △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g)? △H<0
2HNO3(l) +NO(g)? △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是? ▲?。
A.适当升高温度
B.适当增大吸收塔内的压强
C.增大空气中O2的浓度
D.吸收塔内填充瓷环,增大气液接触面
 m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。