微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是 ;转移电子的物质的量为 mol。
(2)反应后,若产生14g N2,则有 g NH3被氧化。
参考答案:(1)NH3(1分)、2 mol (3分);(2)17g(3分)
本题解析:(1)氧化还原反应中,有元素化合价升高的物质被氧化,NH3中氮元素化合价升高,被氧化;1mol氯气转移电子2mol;(2)每生成1mol N2有2molNH3被氧化,产生14g N2,被氧化的NH3为1mol。
考点:考查氧化还原反应。
本题难度:一般
2、选择题 下列有关化学用语使用正确的是(?)
A.CO2的电子式: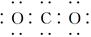
B.氘表示为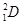
C.S2-离子的结构示意图:
D.乙烯的比例模型:
参考答案:D
本题解析:A项,CO2的电子式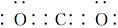 ;B项,应表示为
;B项,应表示为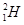 或D;C项,应表示为
或D;C项,应表示为 。
。
本题难度:一般
3、填空题 (10分) 水热法制备Fe3O4纳米颗粒的反应是 3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2 H
H 2O,回答下列问题:
2O,回答下列问题:
( 1 ) . X== .
(2).该反应中的还原剂是 。
(3). 1 m ol Fe2+被氧化时,被Fe2+还原的O2
ol Fe2+被氧化时,被Fe2+还原的O2 的物质的量
的物质的量 为 .
为 .
(4). 该反应中,每生成1 mol Fe3O4,该反应 转移的电子总的物质的量为 。
转移的电子总的物质的量为 。
( 5 ). Na 2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式:
2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式:
。
参考答案:

本题解析:略
本题难度:困难
4、简答题 将5.6g铁粉放入200ml的某浓度的盐酸中,恰好完全反应,求:
(1)铁粉的物质的量是______;
(2)写出其反应的离子方程式
(3)盐酸的浓度(计算过程):
(4)生成H2在标准状况下的体积为______;
(5)如果把盐酸改为稀硫酸,则稀硫酸的浓度为______.
参考答案:(1)n(Fe)=mM=5.6g56g/mol=0.1mol,故答案为:0.1mol;
(2)Fe为活泼金属,与H+反应置换出H2,反应的离子方程式为Fe+2H+=H2↑+Fe2+,
答:反应的离子方程式为Fe+2H+=H2↑+Fe2+;
(3)根据方程式计算:
Fe+2HCl=H2↑+FeCl2
1mol 2mol22.4L
0.1moln V
n=0.2mol,c(HCl)=0.2mol0.2L=1moL/L,
答:盐酸的浓度为1moL/L.
(4)由(3)可知:
V=22.4L×0.1mol1mol=2.24L,故答案为:2.24L;
(5)如果把盐酸改为稀硫酸,则n(H2SO4)=12n(HCl)=12×0.2mol=0.1mol,
c(H2SO4)=0.1mol0.2L=0.5mol/L,
故答案为:0.5mol/L.
本题解析:
本题难度:简单
5、简答题 为了测定小苏打样品的变质情况,取13.7g固体样品加到100mL盐酸溶液中,恰好完全反应.产生的气体体积如图所示.请计算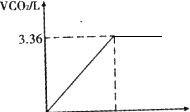
(1)所用盐酸的物质的量浓度.
(2)所取小苏打样品纯度.
参考答案:n(CO2)=3.36L22.4L/mol=0.15mol,
设混合物中含有xmolNa2CO3,ymolNaHCO3,
则
本题解析:
本题难度:一般