微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水的电离过程为H2O H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,?KW(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,?KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃)
D.水的电离是吸热的过程
参考答案:D
本题解析:
水在电离的过程中温度升高,有利于水的电离,它是一个吸热过程。纯水中c(H+)和c(OH-)都增大,电离常数K及水的离子积都增大,但纯水中c(H+)=c(OH-),故选D。
本题难度:简单
2、选择题 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)=CO(g) △H= -393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= -2800 kJ/mol
参考答案:D
本题解析:
本题难度:简单
3、计算题 某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示:
(1)求该温度下,中性溶液的pH;
(2)求该温度下0.01mol/LNaOH溶液的PH;
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。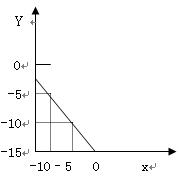
参考答案:(1)7.5 (2)13?(3)1017-a-b%
本题解析:略
本题难度:简单
4、选择题 室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3)
C.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
D.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-)
参考答案:B
本题解析:NaHSO3溶于水后存在如下过程:
NaHSO3=2Na++HSO3-;? HSO3-?H++SO32-;? HSO3-+H2O?H2SO3+OH-;由于溶液的pH=4,即NaHSO3在水溶液中以电离为主,水解为次。即分析得:水电离出的H+的浓度是1.0×10-10mol·L-1 A错;在盐溶液中,离子浓度大小的分析为,未电离和未水解的离子为主,B正确;C选项为物料守恒,正确;D为质子守恒,错误;
本题难度:一般
5、填空题 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
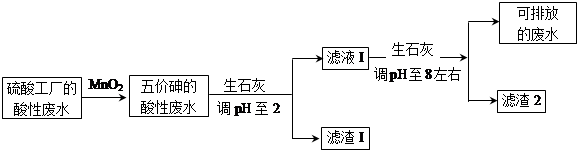
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物
| Ksp
|
Ca3(AsO4)2
| 6.8×10-19
|
CaSO4
| 9.1×10-6
|
FeAsO4
| 5.7×10-21
|
?
表2.工厂污染物排放浓度及允许排放标准
污染物
| H2SO4
| As
|
废水浓度
| 29.4g/L
| 1.6g·L-1
|
排放标准
| pH 6~9
| 0.5mg·L-1
|
?
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=?mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)=?mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为?。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为?;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为?
?。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3?K2=1.7×10-7?K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=?。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O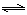 HAsO42-+OH-,该步水解的平衡常数(25℃)为:?(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为:?(保留两位有效数字)。
参考答案:(17分)
(1)0.3 (2分)
(2)5.7×10-17(2分)
(3)2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O (3分)
(4)①CaSO4(2分)
②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀(3分)[或:pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀]
③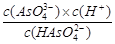 ?(2分)? 2.5×10-3(3分)
?(2分)? 2.5×10-3(3分)
本题解析:(1)读表2中信息,以1L废水为研究对象,其中含有29.4gH2SO4,由于硫酸的相对分子质量为98,m/M=n,则n(H2SO4)=29.4g÷98g/mol=0.3mol,由于c=n/V,则c(H2SO4)=0.3mol÷1L=0.3mol/L;(2)FeAsO4是难溶盐,废水中存在其沉淀溶解平衡:FeAsO4 (s) Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)?c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s)
Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)?c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s) Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)
Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)  3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4
3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4 H++H2AsO4-、H2AsO4-
H++H2AsO4-、H2AsO4- H++HAsO42-、HAsO42-
H++HAsO42-、HAsO42- H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3="[" c(H+)? c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+)? c(OH-),AsO43-+H2O
H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3="[" c(H+)? c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+)? c(OH-),AsO43-+H2O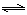 HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)?c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)?c(OH-)? c(H+)]/[ c(H+)?c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)?c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)?c(OH-)? c(H+)]/[ c(H+)?c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
本题难度:困难