|
高中化学知识点总结《有关氧化还原反应的计算》高频考点巩固(2017年模拟版)(六)
2017-07-10 20:36:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
A.该硫酸试剂可以做干燥剂,干燥任何气体
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol?L-1的稀硫酸需取该硫酸50.0mL
D.常温下,2.7gAl与足量的稀硫酸反应得到H23.36L
| 
参考答案:该浓H2SO4的物质的量浓度c=1000×1.84×98%98mol/L=18.4mol/L,
A、该硫酸为浓硫酸,具有强氧化性,不能干燥碱性气体和还原性气体,故A错误;
B、等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=V?ρ1×98%?V?ρ1+V?ρ2×100%=ρ1×98%ρ1+ρ2×100%,因硫酸的密度大于水的密度,则ρ1>ρ2,所以ρ1×98%ρ1+ρ2×100%>49%,故B错误;
C、根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL×18.4mol/L=
200mL×4.6mol/L,解得:x=50,所以应量取的浓硫酸体积是50mL,故C正确;
D、2.7gAl的物质的量为0.1mol,由关系式2Al~3H2可知,生成氢气0.15mol,若为标准状况氢气体积为0.336L,不是标准状况,不能使用气体摩尔体积22.4L/mol,故D错误.
故选:C.
本题解析:
本题难度:一般
2、选择题 下列表示工业生产主要反应的化学方程式正确的是
[? ]
A.煅烧黄铁矿:2FeS2+5O2 2FeO +4SO2 2FeO +4SO2
B.高炉炼铁:Fe2O3 +3C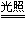 2Fe+3CO 2Fe+3CO
C.联合制碱法:NaCl+NH3+CO2+H2O=NaHCO3↓+ NH4Cl
D.工业法合成盐酸:H2+Cl2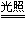 2HCl 2HCl
参考答案:C
本题解析:
本题难度:简单
3、简答题 为测定某碳酸钠样品的纯度,取一定量碳酸钠(Na2CO3)样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不参与反应),生成二氧化碳气体224mL(标准状况).
(1)写出该反应的化学方程式______;
(2)碳酸钠的摩尔质量为______;
(3)该碳酸钠样品中碳酸钠的质量为______;
(4)参与反应的盐酸的物质的量浓度______.
参考答案:n(CO2)=0.224L22.4L/mol=0.01mol,
(1)反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(2)碳酸钠的摩尔质量为M(Na2CO3)=(2×23+12+3×16)g/mol=106g/mol,故答案为:106g?mol-1;
(3)Na2CO3+2HCl=2NaCl+CO2↑+H2O
106g 1mol
m0.01mol
m=1.06g,
故答案为:1.06g;
(4)Na2CO3+2HCl=2NaCl+CO2↑+H2O
2mol 1mol
n 0.01mol
n=0.02mol,
c(HCl)=0.02mol0.04L=0.5mol/L,
故答案为:0.5mol/L.
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是
A.在化学反应中某元素由化合物变为单质,该元素一定是被还原了
B.失电子难的原子获得电子能力一定强
C.卤族元素的原子半径随核电荷数的增加而减少
D.卤族元素中,核外电子数少的元素一定比核外电子数较它多的元素活泼
参考答案:D
本题解析:A:例如KI中的碘元素可被氧化为碘单质,不正确
B:碳得失电子均较差,不正确
C:卤族元素的原子半径随核电荷数的增加而增加,不正确
D:正确
本题难度:一般
5、简答题 某同学将一定量铜粉与10mL的浓硫酸充分反应,生成的气体为1.12L(已换算为标准状况下).
(1)反应消耗铜的质量为______g.
(2)若往反应后溶液中滴加5mol?L-1NaOH溶液至铜离子恰好全部转变为Cu(OH)2沉淀,消耗NaOH?52mL,则原浓硫酸的浓度为______mol?L-1.
(3)测得原硫酸溶液的密度为1.8g?cm-3,则原硫酸的质量分数为______.
参考答案:(1)n(SO2)=1.12L22.4L/mol=0.05mol,
Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O
1?1
n(Cu)? 0.05mol
n(Cu)=0.05mol,
m(Cu)=0.05mol×64g/mol=3.2g,
故答案为:3.2;
(2)由反应H2SO4+2NaOH=Na2SO4+H2O,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
可知:若往反应后溶液中滴加5mol?L-1NaOH溶液至铜离子恰好全部转变为Cu(OH)2沉淀,反应后溶液溶质为Na2SO4,
且n(Na2SO4)=12×n(NaOH)=12×0.052L×5mol/L=0.13mol,
则根据S元素守恒可知原浓硫酸溶液中:n(H2SO4)=n(Na2SO4)+n(SO2)=0.13mol+0.05mol=0.18mol,
则原浓硫酸的浓度为:c(H2SO4)=0.18mol0.01L=18mol/L,
故答案为:18;
(3)溶质的质量为:0.18mol×98g/mol=17.64g,
溶液的质量为:10ml×1.8g/ml=18g,
则原硫酸的质量分数为:17.64g18g×100%=98%,
故答案为:98%.
本题解析:
本题难度:一般
| 