微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表列出了①~⑥六种元素在周期表中的位置:
请按要求回答下列问题:
(1)元素①的气态氢化物的化学式是______元素②的单质电子式是______
(2)元素①,②的最高价氧化物的水化物的酸性强弱为______>______(填化学式)
(3)元素⑤的原子结构示意图是______
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)______
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式)______
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为:______
向上述反应后的溶液中再加入元素④的单质,发生反应的离子方程式为:______.
参考答案:根据元素周期表知,①是C、②是N、③是Na、④是Al、⑤是S、⑥是Cl元素,
(1)元素①的气态氢化物是甲烷,元素②的单质是氮气,氮气分子中氮原子间存在共价三键,所以其电子式为 ,
,
故答案为:CH4; ;
;
(2)同一周期元素,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强其最高价氧化物的水化物酸性越强,N元素的非金属性大于C元素,所以硝酸的酸性大于碳酸,故答案为:>;
(3)元素⑤是S元素,其原子核外有16个电子,有3个电子层,最外层有6个电子,所以其原子结构示意图为: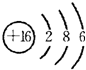 ,故答案为:
,故答案为: ;
;
(4)同一周期中,元素的原子半径随着原子序数的增大而减小,所以第三周期中原子半径最小的元素是氯元素,故答案为:Cl;
(5)这六种元素的最高价氧化物中,属于两性氧化物的是氧化铝,其化学式为Al2O3,故答案为:Al2O3;
(6)钠和水反应生成氢氧化钠和氢气,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2H2O+2OH-=2AlO2-+3H2↑.
本题解析:
本题难度:一般
2、选择题 元素的化学性质主要决定于原子的
A.核电荷数
B.质子数
C.中子数
D.核外电子数,特别是最外层电子数
参考答案:D
本题解析:从原子结构上看,核外电子数及其排布,最外层有多少电子,决定了元素得失电子的能力(金属性和非金属性),即决定了元素的化学性质.
本题难度:一般
3、推断题 (12分)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A________;C________.
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
参考答案:(每空2分,共12分)
(1)①H2SO4 ②酸雨
(2)①N2 NO2
②Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O?属于
本题解析:(1)B是能使品红溶液褪色的有刺激性气味的无色气体,可断定B为SO2,A为S,C为SO3,D为H2SO4,且会形成酸雨。(2)C是红棕色的气体,可断定C为NO2,B为NO,A为N2,D为HNO3。Cu与HNO3(浓)反应生成NO2气体,其反应方程式为:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,分析反应中元素的化合价发生了变化,故次化学反应属于氧化还原反应。
点评:本题重点考查的是无机反应,涉及到S和N2的相关联的化学反应,且发生的化学反应都源自于教材,只有学生认真学习教材知识,问题就迎刃而解了。
本题难度:一般
4、填空题 下表是周期表中的一部分,根据A ~I 在周期表中的位置,用元素符号或化学式回答下列问题:

(1)表中元素,化学性质最不活泼的是?__?,只有负价而无正价的是?___?,?可用于制半导体材料的元素是?_____。?
(2)最高价氧化物的水化物碱性最强的是?__?,酸性最强的是?_____?,呈两性的是?__?;
(3)A 分别与D 、E 、F 、G 、H 形成的化合物中,最稳定的?__?;?
(4)在B 、C 、D 、J 、 E 、F 、G 、H 中,原子半径最大的是?___?。
参考答案:(1 )Ar ;F; Si
(2)NaOH;HClO4 ; Al(OH)3
(3)HF
(4)Na
本题解析:
本题难度:一般
5、选择题 A、B两主族元素属于同一周期,它们的原子能以共价键结合成化学式为AB2型分子,A、B元素在周期表中的族序数可能为( )
A.ⅠA、ⅤA
B.ⅠA、ⅦA
C.ⅣA、ⅥA
D.ⅡA、ⅦA
参考答案:化学式为AB2型的分子中,A的化合价可能为+2或+4价,B的化合价可能为-1或-2价,则
A.ⅠA族的化合价为+1价,ⅤA族的化合价可能为+5价或-3价,二者形成的化合物为BA3,故A错误;
B.ⅠA族的化合价为+1价,ⅦA族的化合价可能为+7价或-1价,二者形成的化合物为AB,故B错误;
C.ⅣA族的化合价可能为+2或+4价,ⅥA族的化合价可能为+4、+6价或-2价,二者形成的化合物能以共价键结合成化学式为AB2型分子,如CO2、CS2,故C正确;
D.ⅡA族的化合价为+2价,为金属元素,,ⅦA族的化合价可能为+7价或-1价,二者能形成化学式为AB2型物质,但为离子化合物,以离子键结合,故D错误.
故选C.
本题解析:
本题难度:一般