微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于原电池的叙述中正确的是( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
参考答案:A、原电池是把化学能转变为电能的装置,故A正确.
B、原电池负极上失电子发生氧化反应,故B错误.
C、原电池在在工作时其负极不断产生电子并经外电路流向正极,故C错误.
D、原电池的电极可由两种不同的金属构成,也可由金属和能导电的非金属构成,故D错误.
故选A.
本题解析:
本题难度:简单
2、选择题 镁—H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是
A.电池总反应为Mg+H2O2 = Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e- = 2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
参考答案:B
本题解析:据据物质的性质判断原电池的正负极,正确书写电极反应式为解答该题的关键;镁—H2O2酸性燃料电池中,活泼金属Mg失去电子被氧化,应为原电池的负极,电极反应式为Mg-2e-=Mg2+, H2O2得电子被还原,生成H2O,正极电极反应式为H2O2+2e-+2H+=2H2O,则电池总反应为Mg+H2O2+2H+=Mg2++2H2O,根据电极反应式和总反应式判断溶液离子浓度的变化;A、根据上述分析知,电池总反应式为Mg+H2O2+2H+=Mg2++2H2O,错误;B、H2O2得电子被还原,生成H2O,正极电极反应式为H2O2+2H++2e- = 2H2O,正确;C、工作时,正极电极反应式为H2O2+2e-+2H+=2H2O,消耗H+,则pH增大,错误;D、电池工作时,溶液中的H+向正极移动,错误。
本题难度:一般
3、选择题 海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4A1(OH)3,下列说法错误的是(?)
A.该装置能实现化学能转化为电能
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面
D.该电池通常只需更换铝板就可继续使用
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极,所以正极得到电子,发生还原反应。根据总反应式可判断,铝是还原剂,作负极,失去电子被溶解。氧气是氧化剂,在正极得到电子,被还原,所以选项B是错误的,答案选B。
本题难度:一般
4、选择题 结合下图判断,下列叙述正确的是?
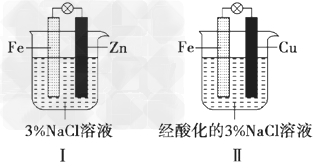
[? ]
A.?I和II中正极均被保护
B.?I和II中负极反应均是Fe-2e-=Fe2+
C.?I和II中正极反应均是O2+2H2O+4e-=4OH-
D.?I和II中分别加入少量KSCN和氯水溶液,溶液均变为血红色
参考答案:A
本题解析:
本题难度:一般
5、计算题 研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g)?△H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
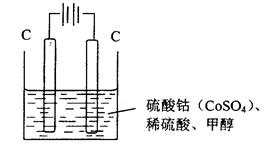
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
参考答案:(12分)(1)①0.13mol/(L?min)(2分) ②放热(1分) ③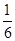 (2分)
(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l)?△H=-442.8kJ/mol (3分,方程式2分,数值1分)
(3)①Co2+-e-=Co3+(2分) ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+(2分)
本题解析:(1)①根据表中数据可知,氢气的物质的量变化量为1.6mol,因此根据反应的方程式可知,CO2的变化量也是1.6mol,其浓度是1.6mol÷2L=0.8mol/L,所以CO2表示的反应速率是v(CO2)=0.8mol/L÷6min=0.13mol/(L?min)。
②根据表中数据可知,实验1中CO的转化率为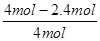 ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为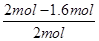 ×100%=20%,因此实验1的转化率大于实验2。这说明温度升高平衡向逆反应方向移动,因此正反应放热。
×100%=20%,因此实验1的转化率大于实验2。这说明温度升高平衡向逆反应方向移动,因此正反应放热。
③平衡时CO的物质的量为1.6mol÷2L=0.8mol/L,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 1? 0.5 ? 0?0
转化浓度(mol/L)? 0.2?0.2?0.2? 0.2
平衡浓度(mol/L)? 0.8?0.3?0.2? 0.2
化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值.所以900℃时该反应平衡常数K=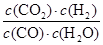 =
=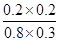 =0.17。
=0.17。
(2)已知反应①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1451.6kJ/mol和反应②2CO(g)+O2(g)=2CO2(g)?△H=-566.0kJ/mol,则根据盖斯定律可知,(①-②)÷2即得CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的反应热△H=(-1451.6kJ/mol+566.0kJ/mol)÷2=-442.8kJ/mol。
(3)①电解池中阳极失去电子,发生氧化反应。因此通电后,Co2+在阳极失去电子氧化成Co3+,所以阳极电极反应式为Co2+-e-=Co3+。
②以Co3+做氧化剂把水中的甲醇氧化成CO2而除去,自身被还原为Co2+,结合原子守恒与电荷守恒可知,该反应的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
本题难度:困难