微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列除杂质的操作中不正确的是( )
A.NaHCO3溶液中混有少量Na2CO3:往该溶液中加入过量Ca(HCO3)2溶液
B.CO2中混有HCl:将其通入饱和NaHCO3溶液
C.铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤
D.NaCl固体中混有少量I2:充分加热
参考答案:A
本题解析:
本题难度:简单
2、实验题 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是_______________,洗涤沉淀并判断沉淀是否洗净的操作是_____________________。
(2)乙组:气体分析法把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是_____________。
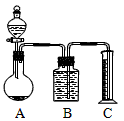
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。方法:_________。用到的主要试剂:_______(至少2种)。用到的玻璃仪器:____________(至少2件)
参考答案:(1)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2已过量 ;沿玻棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次,然后向滤液(洗涤液)中滴加AgNO3溶液判断是否洗净。
(2)饱和NaHCO3溶液 ;从A出来的气体中混有HCl,会与NaHCO3反应生成CO2
(3)滴定分析法(或中和滴定法、滴定法、用标准盐酸滴定一定量的混合物等) ;标准盐酸溶液、指示剂(甲基橙、酚酞) ;酸式滴定管、锥形瓶、 烧杯
本题解析:
本题难度:一般
3、选择题 类推思维是化学解题中常用的一种思维方法,则有关离子方程式的类推正确的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.Na和水反应,最终产物为Cu(OH)2和H2;
B.电解质溶液的酸碱性不同,电极反应不同;
C.根据阴离子的放电顺序不同判断;
D.醋酸为弱电解质.
解答:A.Na性质活泼,与水剧烈反应,将Na加入到CuSO4溶液中,最终产物为Cu(OH)2和H2,不能置换出铜,故A错误;
B.氢氧燃料电池的负极反应为氢气使电子被氧化的反应,酸性溶液中发生H2-2e-=2H+,碱性溶液中发生H2-2e-+2OH-=2H2O,故B正确;
C.由于放电顺序:Cl->OH-,用惰性电极电解CuCl2溶液,阳极生成氯气,故C错误;
D.醋酸为弱电解质,应写成化学式,为CaCO3+2HAc=Ca2++H2O+2Ac-+CO2↑,故D错误.
故选B.
点评:本题考查较为综合,侧重于离子方程式的考查,涉及钠的性质、电解以及原电池等知识,易错点为A,注意钠与水剧烈反应的性质,题目难度不大.
本题难度:一般
4、选择题 在盛有碘水的试管中,加入少量四氯化碳后振荡,静默片刻后,出现的实验现象是
[? ]
A. 整个溶液变紫色
B. 整个溶液变棕色
C. 上层无色,下层紫红色
D. 下层无色,上层紫红色
参考答案:C
本题解析:
本题难度:简单
5、简答题 为测定Na2CO3与Na2SO3混合物中各组分的含量,欲取样品m?g以图所示装置进行实验,已知仪器C中装有品红溶液.(铁架台、铁夹等仪器未在图中画出)
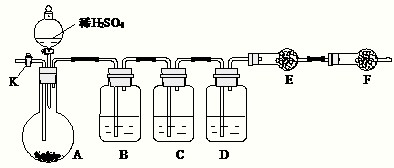
(1)将仪器连接好以后,必须进行的第一步操作是______.
(2)此实验还必须用到的最重要的仪器是______;仪器F的作用是______.
(3)实验室中备有以下常用试剂:
a.浓硫酸? b.品红溶液?c.酸性高锰酸钾溶液?d.饱和碳酸氢钠溶液 e.氢氧化钠溶液?
f.无水硫酸铜?g.碱石灰?h.五氧化二磷?i.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______.
(4)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气.这样做的目的是______.
所通空气应先经过______试剂(填序号)处理,否则可能引起Na2SO3?含量的测量结果比实际值______(填“偏高”、“偏低”或“无影响”).
(5)若要提高实验的准确性,还应在______之间增加装有______(填序号)的球形干燥管装置.
参考答案:由装置图可知,实验原理为:混合物中加入硫酸,转化为二氧化硫、二氧化碳,除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,进而计算各组分的质量分数.
(1)由于需要测定二氧化碳的质量,整套装置应气密性良好,故实验之前应检验装置的气密性;
故答案为:检验装置的气密性;
(2)实验测定二氧化碳的质量,进而计算碳酸钠的质量,要计算质量分数,需要知道样品的总质量,故应需要用托盘天平称量样品的质量;
利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳进入E装置中,影响测量结果;
故答案为:托盘天平;防止空气中的水蒸气、二氧化碳进入E装置中;
(3)进入装置E中的二氧化碳要干燥、不含二氧化硫,故装置B的作用是除去气体中的二氧化硫,试剂保证吸收二氧化硫,不能吸收二氧化碳且不能生成二氧化碳,故选择c(酸性高锰酸钾溶液);
装置C的作用是具有二氧化硫是否除尽,装置D的作用是干燥气体,选择试剂为a(浓硫酸);
E装置的作用是吸收生成的二氧化碳,确定二氧化碳的质量,故可以选择g(碱石灰);
故答案为:c;a;g;
(4)装置内会残留部分二氧化碳,应使二氧化碳区别被装置E中药品吸收,故通入大量的空气目的是排尽装置内的二氧化碳,使生成的二氧化碳能够全部装置E中药品吸收.
由于空气中含有二氧化碳,应先除去空气中的二氧化碳,若不除去空气中的二氧化碳,导致测定二氧化碳的质量增大,计算所得碳酸钠的质量增大,引起测定的a2S03质量减小,导致Na2SO3含量偏低,可以使空气先通过氢氧化钠溶液或碱石灰除去含有的二氧化碳;
故答案为:使生成的二氧化碳能够全部装置E中药品吸收;e或g;偏低;
(5)装置E吸收二氧化碳后会生成水,防止装置D的浓硫酸吸收影响二氧化碳的质量测定,故在在D与E之间之间增加装有 氯化钙的球形干燥管装置;
故答案为:在D与E,i.
本题解析:
本题难度:一般