微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
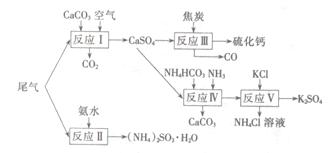
(1)反应III中氧化剂与还原剂的物质的量之比为?。
(2)反应Ⅳ的化学方程式为?。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为?。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下:
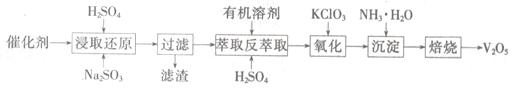
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____?的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为?。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为?。
参考答案:(1)1︰4
(2)NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4
(3)K2SO4在40%的乙二醇溶液中溶解度更小
(4)NH3?H2O
(5)Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O ,? 2︰3。
本题解析:(1)反应III的化学方程式为:CaSO4+4C CaS+4CO↑.在该反应中CaSO4作氧化剂,C作还原剂,它们的物质的量的比为1︰4 。(2)由框图中的信息可知反应Ⅳ的化学方程式为NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4。(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为K2SO4在40%的乙二醇溶液中溶解度更小。(4)若反萃取使用的硫酸用量过大,为中和硫酸消耗的氨水就会增多。所以进一步处理时会增加NH3?H2O的用量。(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O。氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为12:(7×6-12×2)=2:3.
CaS+4CO↑.在该反应中CaSO4作氧化剂,C作还原剂,它们的物质的量的比为1︰4 。(2)由框图中的信息可知反应Ⅳ的化学方程式为NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4。(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为K2SO4在40%的乙二醇溶液中溶解度更小。(4)若反萃取使用的硫酸用量过大,为中和硫酸消耗的氨水就会增多。所以进一步处理时会增加NH3?H2O的用量。(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O。氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为12:(7×6-12×2)=2:3.
本题难度:一般
2、选择题 在容积为1L的干燥烧瓶中,用向下排空气法充入NH3后,测得烧瓶中的气体对氢气的相对密度为9.7。若将此气体进行喷泉实验,当喷泉停止后进入烧瓶中溶液的体积应为
A. L
L
B.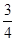 L
L
C.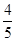 L
L
D. L
L
参考答案:C
本题解析:气体密度比等于相对分子质量比,所以烧瓶中气体平均相对分子质量为19.4。用排空气法收集氨气,氨气不纯,其中混有空气,由十字交叉法: 得氨气和空气体积比为4:1,所以进入烧瓶中溶液的体积为4/5L。
得氨气和空气体积比为4:1,所以进入烧瓶中溶液的体积为4/5L。
点评:掌握十字交叉法的运用。
本题难度:一般
3、选择题 下列说法不正确的是
A.Na2O2晶体中阴离子和阳离子的数目之比为1:2
B.同温同压下等质量的N2和CO两种气体的体积比为1:1
C.同温同压下,相同体积的O2和O3两种气体中的氧原子个数比为1:1
D.等质量的乙烯和环己烷所含质子数比为1:1