微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 白酒,食醋,蔗糖,淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
A.鉴别食盐和小苏打
B.检验自来水中是否含氯离子
C.检验雨水的酸碱度
D.白酒中是否含甲醇
参考答案:A
本题解析:小苏打是碳酸氢钠,而食醋中含有乙酸,能和碳酸氢钠反应生成CO2气体,而食盐是氯化钠,和食醋是不反应的,A可以鉴别;检验氯离子,需要硝酸酸化的硝酸银溶液,B不能鉴别;检验雨水的酸碱度需要pH试纸,C不能鉴别;白酒、食醋、蔗糖和淀粉都不能鉴别白酒中的甲醇,D不正确,因此正确的答案选A。
点评:物质的检验一般依据物质的性质,特别是化学性质。即进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.在标准状况下,11.2LNO与11.2LO2混合后所含分子数目为0.75NA
B.含有共价键数为NA的金刚石晶体的质量为3g
C.28g乙烯、丙烯、丙炔的混合气体中碳原子数大于2NA
D.在0.1mol蓝矾晶体和1L0.1moL?L-1AlCl3溶液中,金属阳离子总数均小于0.1NA
参考答案:C
本题解析:分析:A、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0,75mol;
N2O4,则反应后的气体的物质的量小于0,75mol;
B、金刚石中每个C原子平均形成2个共价键;
C、乙烯、丙烯的最简式相同,都为CH2,28g乙烯、丙烯含有的碳原子为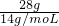 =2mol,丙炔的分子式为C3H4,28g丙炔含有的碳原子为
=2mol,丙炔的分子式为C3H4,28g丙炔含有的碳原子为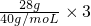 >2mol;
>2mol;
D、AlCl3溶液中Al3+离子发生水解生成H+离子,在0.1mol蓝矾晶体中含有0.1molCu2+离子.
解答:A、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0,75mol,混合后所含分子数目小于0.75NA,故A错误;
N2O4,则反应后的气体的物质的量小于0,75mol,混合后所含分子数目小于0.75NA,故A错误;
B、金刚石中每个C原子平均形成2个共价键,含有共价键数为NA的金刚石晶体的质量为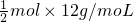 =6g,故B错误;
=6g,故B错误;
C、乙烯、丙烯的最简式相同,都为CH2,28g乙烯、丙烯含有的碳原子为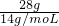 =2mol,丙炔的分子式为C3H4,28g丙炔含有的碳原子为
=2mol,丙炔的分子式为C3H4,28g丙炔含有的碳原子为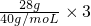 >2mol,所以28g乙烯、丙烯、丙炔的混合气体中碳原子数大于2NA,故C正确;
>2mol,所以28g乙烯、丙烯、丙炔的混合气体中碳原子数大于2NA,故C正确;
D、AlCl3溶液中Al3+离子发生水解生成H+离子,1L0.1moL?L-1AlCl3溶液中,金属阳离子总数小于0.1NA,在0.1mol蓝矾晶体中含有0.1molCu2+离子,金属阳离子总数等于0.1NA,故D错误.
故选C.
点评:本题考查阿伏加德罗常数,题目难度不大,做题时注意物质的组成、结构、性质以及存在的状态和条件等问题,本题此错点为A项和B项.
本题难度:一般
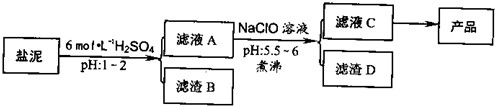
3、简答题 氯碱厂废渣(盐泥)中含有镁钙铁铝的硅酸盐和碳酸盐,其中含镁(以MgO计)约10%,钙(以CaO计)约15%,铁(Ⅱ、Ⅲ)和铝等的含量低于1%.氯碱厂从盐泥中提取MgSO4.7H2O的流程如下:
部分阳离子以氢氧化物沉淀时溶液pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2
pH
5.2
3.2
9.7
11.2
|
溶解度表
| 温度0C | 10 | 30 | 40
CaSO4
0.19
0.21
0.21
|
回答下列问题:
(1)滤渣B的主要成分是:______.
(2)从滤液A得到滤液C,能否用氨水代替NaClO?______,什么理由______,其中加热煮沸的目的是______.
(3)从滤液C中获得产品经过3个操作步骤,分别是______,______,______.
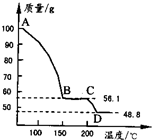
(4)将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如图所示.
据图写出CD段反应的化学方程式______.
参考答案:(1)在含有镁钙铁铝的硅酸盐和碳酸盐中加入硫酸可生成硅酸和硫酸钙沉淀,为H2SiO3(或H4SO4)CaSO4(或CaSO4?2H2O),
故答案为:H2SiO3(或H4SO4)CaSO4(或CaSO4?2H2O);
(2)从滤液A得到滤液C的目的是将Fe2+氧化成Fe3+,利用水解生成沉淀,而氨水不能将Fe2+氧化成Fe3+,则无法沉淀完全,NaClO起到氧化剂的作用,盐类的水解为吸热过程,加入促进水解生成沉淀并防止生成胶体,因加热有利于破坏胶体的稳定性,使沉淀颗粒变大利于后面过滤分离,
故答案为:否;氨水不能将Fe2+氧化成Fe3+,则无法沉淀完全; 加热能使Fe3+和Al3+水解完全,同时因为氢氧化铁和氢氧化铝是胶状沉淀,加热有利于破坏胶体的稳定性,使沉淀颗粒变大利于后面过滤分离;
(3)从滤液中获取晶体,应经过加热浓缩,冷却结晶,过滤等操作,故答案为:加热浓缩,冷却结晶,过滤;? (4)100gMgSO4.7H2O中,m(MgSO4)=100×120246=48.8g,m(H2O)=100g-48.8g=51.2g,
则C点固体中含有水的质量为56.1g-48.8g=7.3g,此时n(H2O)=7.3g18g/mol=0.41mol,n(MgSO4)=48.8g120g/mol=0.41mol,
所以C点使固体的化学式为MgSO4?H2O,D点固体为MgSO4,则CD段反应的化学方程式为MgSO4?H2O?△?.?MgSO4+H2O↑,
故答案为:MgSO4?H2O?△?.?MgSO4+H2O↑.
本题解析:
本题难度:一般
4、选择题 1molN2和44gCO2的气体体积,前者和后者的关系是
A.大于
B.等于
C.小于
D.不能确定
参考答案:D
本题解析:分析:气体的体积和气体的物质的量的多少以及所处的温度压强有关.
解答:根据物质的量和气体体积的关系公式V=nVm可知,要计算1molN2和44gCO2的气体体积,还须知道二者的Vm的大小,而Vm的大小和气体所处的温度压强有关,故不能确定体积的大小.
故选D.
点评:本题考查学生对公式V=nVm的理解和掌握,考查学生分析和解决问题的能力,难度不大.
本题难度:一般
5、选择题 下列有关物质分离方法的叙述中,不正确的是
[? ]
A.用过滤的方法分离溶液和胶体
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.用加热的方法分离氯化钠和氯化铵固体
参考答案:A
本题解析:
本题难度:一般