微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:

(1)反应①阳极的电极反应式?。
(2)反应③的化学方程式?,
(3)反应④的离子方程式为?。
(4)K是一种难溶于水的固体,K受热分解可生成H。实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)?
A.NaOH溶液?B.氨水 ?C.Na2CO3溶液?D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:??
该液体接通直流电后___? __极附近颜色加深,这种过程叫做____? _。
(6)若E中含有合金元素,会导致G不纯。测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。(杂质不参与反应) 则样品中G的质量分数为:? ??。
则样品中G的质量分数为:? ??。
参考答案:
本题解析:略
本题难度:一般
2、推断题 X、Y、Z、W、R、T六种物质的相互转化关系如下图所示(反应条件及部分产物未列出)

(1)如果X、Y、Z都是短周期的非金属单质,且X、Y所含元素同主族,X、Z所含元素同周期。
①已知Y单质 在电子工业中有重要作用,则Y的原子结构示意图为_____;物质T的结构式为_______;
②反应①的化学方程式为______________________。
(2)若X、Y为第四周期常见的金属单质,Z为一种常见的酸,X、Y分别与Z的浓溶液在加热条件下才能发 生明显的化学反应,写出反应④的化学方程式______________________;足量的X与溶液R充分反应后,生成物W中金属阳离子的检验方法为_____________________。
参考答案:(1)① ;O=C=O;②2C+SiO2
;O=C=O;②2C+SiO2 2CO↑+Si
2CO↑+Si
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;取少量W溶液于试管中,滴加KSCN溶液无明显现象,再滴加氯水后,溶液呈血红色
CuSO4+SO2↑+2H2O;取少量W溶液于试管中,滴加KSCN溶液无明显现象,再滴加氯水后,溶液呈血红色
本题解析:
本题难度:一般
3、填空题 (10分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
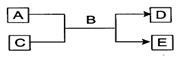
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,
则该反应的化学方程式为:?,
检验D中阴离子所用试剂为:?。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出C
溶液呈强碱性时反应的离子方程式:?。
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的物质的化学式(写两种):?,?。
参考答案:(10分)(1)? Cl2 + SO2 + 2H2O = H2SO4 + 2 HCl(2分)
AgNO3溶液,?稀HNO3(只答AgNO3溶液不给分)(2分)
(2)? 2Al + 2 OH- + 2H2O ="2Al" O2- + 3H2↑(2分)? (3) H2SiO3? Al(OH)3?(每空2分)
本题解析:B为自然界中含量最多的液体,则B是水。(1)如果A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,则A应该是氯气,C是SO2,反应的方程式是Cl2 + SO2 + 2H2O = H2SO4 + 2 HCl。相对分子质量E>D,所以E是硫酸,D是氯化氢。实验室检验氯离子的试剂是硝酸酸化的硝酸银。
(2)A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行,所以A是单质铝,和强碱反应的离子方程式是2Al + 2 OH- + 2H2O ="2Al" O2- + 3H2↑。
(3)C为引起温室效应的主要气体,则C是CO2。又因为A、C均为化合物,E为白色沉淀,所以该反应是碳酸制取比碳酸还弱的酸的复分解反应,所以E可能是硅酸或氢氧化铝。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
4、填空题 (14分)A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。

请回答下列问题:
(1)A的化学式为?。
(2)H与I溶液混合后,发生反应的离子方程式是?。
G→J的化学方程式为?。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性原因?。
(4) 实验证明,硝酸发生氧化还原反应时,硝酸越稀对应还原产物中氮元素的化合价越低。某同学取一定量的C、E合金与一定量的很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入一定浓度的氢氧化钠溶液,所加氢氧化钠的物质的量与产生的沉淀的物质的量(mol)的关系如左图所示。试回答下列问题:
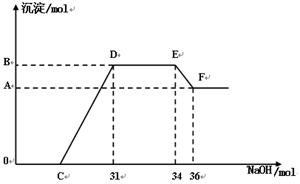
①图中OC段没有沉淀生成,此阶段发生的离子方程式为:_______________________________。
②在DE段没有沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:_________________________________;
③B点对应的沉淀量为________________ mol,C点对应的横坐标为___________mol。
参考答案:(1)Al2O3(2分)
(2)3AlO2-+Al3++6H2O=4Al(OH)3↓?(2分)4Fe(OH)2+2H2O+O2═4Fe(OH)3?(2分)
(3)Fe3++3H2O  ?Fe(OH)3+3H+(或写化学方程式)2分)
?Fe(OH)3+3H+(或写化学方程式)2分)
(4)①H++OH-====H2O?(2分)
②NH4++OH-==NH3·H2O(2分)?③8 (1分)? 7(1分)
本题解析:本题是无机框图题,关键是找准突破点。A是一种高熔点物质,J是一种红褐色沉淀,所以A是氧化铝,J是氢氧化铁,则D是氧化铁,C是铝,B是氧气,E是铁,F是氯化亚铁,G是氢氧化亚铁,H是偏铝酸钠,I是氯化铝。
(1)氧化铝度化学式是Al2O3。
(2)偏铝酸钠和氯化铝水解相互促进,生成氢氧化铝,反应的方程式是3AlO2-+Al3++6H2O=4Al(OH)3↓;氢氧化亚铁不稳定,极易被氧化生成氢氧化铁,方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3 。
(3)氧化铁溶于盐酸生成氯化铁。氯化铁水解,溶液显生成,方程式是Fe3++3H2O  ?Fe(OH)3+3H+。
?Fe(OH)3+3H+。
(4)①图中OC段没有沉淀生成,说明硝酸是过量的,所以反应的方程式H++OH-====H2O。
②在DE段没有沉淀的物质的量没有变化,说明溶液中还含有NH4+,所以反应的方程式是NH4++OH-==NH3·H2O。
③根据图像可知,NH4+消耗的氢氧化钠是3mol,因此反应中转移电子的物质的量是24mol。溶解氢氧化铝消耗的氢氧化钠是2mol,则生成氢氧化铝消耗的氢氧化钠是6mol,所以金属铝的物质的量是2mol,失去6mol电子,因此根据电子的得失守恒可知,铁的物质的量是(24mol-6mol)÷3=6mol,所以BB点对应的沉淀是8mol。生成6mol氢氧化铁消耗氢氧化钠是18mol,所以C点是31mol-18mol-6mol=7mol。
本题难度:一般
5、选择题 如图中M、N为含X元素的常见化合物,则X元素为

A.C或Al
B.Cu和
C.N或S
D.Fe或C
参考答案:D
本题解析:略
本题难度:一般