微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
阳离子
| Na+、Ba2+、NH4+、K+
|
阴离子
| CH3COO-、Cl-、OH-、SO42-
|
?
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是____________。
(2)用离子方程式表示A的水溶液显碱性的原因______________________________。
(3)25 ℃时pH=9的A溶液和pH=9的C溶液中水的电离程度较小的是________(填写A或C的化学式)。
(4)25 ℃时用惰性电极电解D的水溶液,一段时间后溶液的pH________7(填“>”、“<”或“=”)。
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________________________________________。
(6)室温时在一定体积0.2 mol·L-1的C溶液中,加入一定体积的0.1 mol·L-1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________。
参考答案:(12分)(1)醋酸钾?(2)CH3COO-+H2O CH3COOH+OH- (3)Ba(OH)2? (4)=
CH3COOH+OH- (3)Ba(OH)2? (4)=
(5)c(OH-)>c(Ba2+)=c(Cl-)>c(NH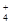 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH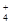 )>c(H+) (6)2∶3
)>c(H+) (6)2∶3
本题解析:(1)D溶液焰色反应显黄色,说明含有Na+。C溶液和D溶液相遇时只生成白色沉淀,则白色沉淀是硫酸钡,因此D是硫酸钠。B溶液和C溶液相遇时只生成有刺激性气味的气体,则该气体是氨气。又因为A、C溶液的pH均大于7,B溶液的pH小于7,所以B是氯化铵,则C氢氧化钡,A就是醋酸钾。
(2)醋酸钾是强酸弱碱盐,水解显碱性,即CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(3)醋酸钾水解促进水的电离,氢氧化钡是强碱,抑制水的电离,所以溶液中水的电离程度较小的是Ba(OH)2。
(4)惰性电极电解硫酸钠溶液,则实质是电解水,溶液始终显中性,即pH=7。
(5)等体积、等物质的量浓度的B溶液和C溶液混合后,氢氧化钡过量,因此反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH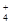 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH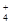 )>c(H+)。
)>c(H+)。
(6)混合溶液的pH=13,即OH-的浓度是0.1mol/L。这说明氢氧化钡是过量的,则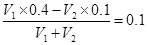 ,解得
,解得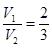 。
。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,难易适中、注重考查学生分析问题、以及灵活运用基础知识解决问题的能力。有助于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率。
本题难度:一般
2、实验题 (8分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

请回答:
(1)步骤⑦需采用的主要物质分离提纯操作,名称是?,所需要的实验仪器和用品除铁架台、酒精灯、玻璃棒外,还要?。
(2)步骤③加入过量NaOH的目的是:?
(3)步骤⑥需加入适量的?(填试剂名称),所发生反应的离子方程式为:?
参考答案:(1)蒸发,?蒸发皿;?(2)溶液中存在的 Mg2+ 和 Fe3+完全转化为沉淀除去。
(3)盐酸?OH-+H+= H2O?CO32-+2H+=H2O+CO2?
本题解析:(1)由溶液变成晶体的操作叫蒸发,需要用的一起除铁架台、酒精灯、玻璃棒外,还要蒸发皿。
(2)步骤③加入过量NaOH的目的是溶液中存在的 Mg2+ 和 Fe3+完全转化为沉淀除去。
(3)滤液I中还有大量的OH-、CO32-杂质离子,所以需要加盐酸除去。发生的离子方程式为:OH-+H+=H2O CO32-+2H+=H2O+CO2?
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
3、实验题 (8分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们,做了以下实验。
(1)将固体溶于水,搅拌后得到无色透明溶液;
(2) 往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3) 过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解,试判断:
①.固体混合物中肯定有?;肯定没有?;可能有??;对可能有的物质,可采用往滤液中滴加?试剂的方法来检验。
②.操作(2)中反应的离子方程式?。
③.操作(3)中反应的化学方程式?。
参考答案:(每空2分)(方程式不配平的给0分)
①肯定有Na2CO3;肯定没Na2SO4、CuSO4、CaCl2;可能有NaCl?;滴加 AgNO3。
②操作⑵离子方程式Ba2+ + CO32-=BaCO3↓
③操作⑶化学方程式。BaCO3 + 2H+=Ba2+ + H2O + CO2↑
本题解析:①取固体混合物样品溶于水搅拌后得到无色溶液,由于硫酸铜溶液为蓝色,所以说明一定不含硫酸铜;
②取部分此溶液加入硝酸钡溶液,有白色沉淀生成,根据题干给出的物质,所形成的沉淀可能为碳酸钡或硫酸钡,所以混合物中可能含碳酸钠或硫酸钠,综合(1)得到无色溶液(2)可能含碳酸钠或硫酸钠,而碳酸钠或硫酸钠可与氯化钙形成沉淀,故混合物中一定不含氯化钙;
③在白色沉淀中加入足量的稀硝酸,沉淀最后全部溶解,说明沉淀为碳酸钡,故一定含有碳酸钠,一定不含硫酸钠,实验中未涉及到氯化钠的检验,所以无法确定是否含有,要确定氯化钠的存在,可用硝酸银溶液,由于混合物中含有的碳酸钠会造成干扰,所以可先加硝酸除去.
故答案为:Na2CO3;Na2SO4、CaCl2、CuSO4;NaCl;HNO3酸化的AgNO3;
③碳酸钡是可以溶于强酸的白色沉淀,实质是:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O.
点评:本题为混合物组成的推断题,完成此类题目,要抓住题干叙述的解题突破口,直接得出结论,然后利用顺向或逆向推测其他物质,从而得出结论。
本题难度:一般
4、选择题 下列试剂不能鉴别己烯、丙醛和苯酚溶液的是
A.银氨溶液
B.FeCl3溶液
C.新制氢氧化铜悬浊液
D.酸性高锰酸钾溶液
参考答案:D
本题解析:A中常温下混合后分成两组,已烯不溶于水,丙醛、苯酚与硝酸银溶液互溶,加热后丙醛组会
形成银镜;
B中常温下即可鉴别,其中已烯不溶分成两层,丙醛无明显现象,混溶为一体。苯酚形成紫色溶液;
C中与A中分析过程相同,加热后丙醛与新制氢氧化铜溶液形成砖红色沉淀;
D中前两组均褪色,故不可鉴别。
本题难度:一般
5、选择题 下列除杂质的方法中正确的是(?)
A.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液
B.乙烷中混有乙烯,通入H2,在一定条件下反应使乙烯完全转化成乙烷
C.苯甲醛中混有苯甲酸,加入生石灰后,再加热蒸馏
D.溴苯中含有单质溴加入KI溶液后用分液漏斗分液
参考答案:C
本题解析:A、除去乙醇中混有乙酸,应加入生石灰后蒸馏,错误;B、除去乙烷中混有乙烯,应将混合气通入盛有溴水的洗气瓶,错误;C、苯甲醛中混有苯甲酸,加入生石灰后,再加热蒸馏,正确;D、溴苯中含有单质溴加入KI溶液,溴苯中会引入新的杂质单质碘,错误。
本题难度:一般