微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某溶液中c(Na+)=0.2mol?L-1,c(Mg2+)=0.4mol?L-1,c(Cl-)=0.4mol?L-1,如果溶液中还有SO42-,那么c(SO42-)应为( )
A.0.1?mol?L-1
B.0.15?mol?L-1
C.0.3?mol?L-1
D.0.5?mol?L-1
参考答案:溶液中电荷守恒,故c(Na+)+2c(Mg2+)=c(Cl+)+2c(SO42-),所以
0.2mol?L-1+2×0.4mol?L-1=0.4mol?L-1+2c(SO42-),
解得:c(SO42-)=0.3?mol?L-1,
故选C.
本题解析:
本题难度:简单
2、填空题 (1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式:?。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为??g。
参考答案:(4分)(1)CaCO3(s)=CaO(s) +? CO2(g)?ΔH=+175.6kJ·mol-1?(2)4.16
本题解析:(1)10g CaCO3分解需要吸收17.56kJ 热量,则1mol即100g碳酸钙分解需要消耗的能量是175.6kJ,因此该反应的热化学方程式是CaCO3(s)=CaO(s) +? CO2(g)?ΔH=+175.6kJ·mol-1。
(2)碳酸氢钠分解的方程式是2NaHCO3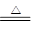 Na2CO3+H2O+CO2↑?△m↓
Na2CO3+H2O+CO2↑?△m↓
2×84g? 106g? 62g
m? 0.31g
解得m=(62g×0.31g)÷168g=0.84g
所以原混合物中碳酸钠的质量为5.00g-0.84g=4.16g
点评:该题是基础性试题的考查,难度不大,有利于培养学生规范的答题能力,在计算碳酸钠的质量时,注意利用好差量法,注意有关解题方法的归纳和总结。
本题难度:一般
3、填空题 (8分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl—、ClO—、ClO3—三种含氯元素的离子,其中ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
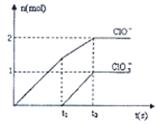
(1)t1前,氧化产物是________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:?。
(3)该石灰乳中含有Ca(OH)2的物质的量是?mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是?。
A.NaCl、Cl2
B.NaCl、NaClO
C.NaClO3、NaClO4
D.NaCl、NaClO3
参考答案:(1)Ca(ClO)2?(2)5Ca(OH)2+5Cl2=5Ca2++7Cl-+2ClO-+ClO3—+5H2O?(3)5 (4)D
本题解析:(1)根据图像可知,t1之前氧化产物是Ca(ClO)2。
(2)t2时,氧化产物既有Ca(ClO)2、还有Ca(ClO3)2,二者的物质的量分别是是1mol和0.5mol,所以转移电子是7mol,则生成3.5mol氯化钙,因此方程式为5Ca(OH)2+5Cl2=5Ca2++7Cl-+2ClO-+ClO3—+5H2O。
(3)根据原子守恒可知,氢氧化钙的物质的量是1mol+0.5mol+3.5mol=5mol。
(4)亚氯酸钠固体爆炸所以自身的氧化还原反应,所以氯元素的化合价既有升高的,还有降低的,则答案选D。
本题难度:一般
4、选择题 用NA表示阿佛加德罗常数,下列说法正确的是
A.22.4L H2的物质的量约为1mol
B.标准状况下,11.2L H2O的物质的量约为1 mol
C.1 L 1mol/L的MgCl2溶液中Cl-的物质的量浓度为 2mol/L
D.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA
参考答案:C
本题解析:A错,应在标准状况下;B错,标准状况下水不是气体;C正确;D错,0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.2NA
本题难度:一般
5、选择题 有一瓶14%的氢氧化钾溶液,加热蒸发掉100g水后,得到28%的氢氧化钾溶液80mL,所得溶液的浓度为( )
A.5mol/L
B.6mol/L
C.6.25mol/L
D.6.5mol/L
参考答案:设14%氢氧化钾溶液的质量为x,蒸发前后溶质的质量不变,则有x×14%=(x-100g)×28%,x=200g,
28%的氢氧化钾溶液中含有氢氧化钾的物质的量为100g×28%56g/mol=0.5mol,
所得溶液的物质的量浓度为0.5mol0.08L=6.25mol/L,
故选C.
本题解析:
本题难度:一般