微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 制备硅单质时,主要化学反应如下:
(1)SiO2+? 2C ?Si+2CO↑
?Si+2CO↑
(石英沙) (焦炭) (粗硅)
(2)Si(粗)+2Cl2 SiCl4
SiCl4
(3)SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
对上述三个反应的叙述中,不正确的是
[? ]
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.在3个反应中硅元素均被还原
参考答案:D
本题解析:
试题分析:
选项A,(1)(3)为置换反应,符合置换反应的定义,有单质参加,又有单质生成,正确;
选项B,(1)(2)(3)均为氧化还原反应,三个反应的化合价均变化,正确;
选项C,(2)为化合反应,符合化合反应的定义,多种物质反应生成一种物质,正确;
选项D,在3个反应中(1)(3)硅元素均被还原,(2)反应中硅被氧化,错误。
故选:D
本题难度:简单
2、实验题
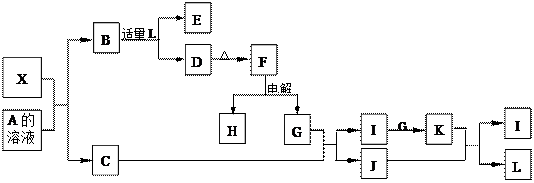 (12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
(12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________?__________;
写出K与J反应的化学方程式:____________________________?_____。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。?+2N2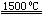 4X+SiC+3C。
4X+SiC+3C。
参考答案:(1)AlN(2分),原子(2分);
(2)AlN+NaOH+H?2O=NaAlO2+NH3↑(3分),3NO2?+H2O=2HNO3+NO(3分)
(3)Al4SiC4(2分)
本题解析:(1)由题意“X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近”知,X与碳化硅(SiC)是等电子体,电子数目为20。又由“C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性”可知C为NH3,D为Al(OH)3;则F为Al2O3,G为O2,I为NO,J为H2O,K为NO2,L为HNO3 ;又“E溶液的焰色反应中呈黄色火焰”,则B必为NaAlO2,A为NaOH,X就为AlN,通过电子数为20可以进一步得到确证。
(2)略
(3)由质量守恒定律可求出方框中填新物质的化学式为:Al4SiC4
本题难度:简单
3、填空题 在8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O反应中,
(1)在上述化学方程式中用双线桥标明电子转移的方向和数目。
(2) 元素发生了还原反应, 是氧化剂。(填元素符号或化学式)
(3)上述反应中,还原剂和氧化剂的物质的量之比是___________;若生成1mol气体,则转移的电子数是_____________。
参考答案:(1)“略”
(2)N;HNO3
(3)3:2;3NA
本题解析:
本题难度:一般
4、填空题 一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+?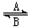 ?Fe3+。在过程A中,Fe2+作?剂。
?Fe3+。在过程A中,Fe2+作?剂。
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有?性。
(3)某同学要检验Fe3+,向溶液中加入 ?(写化学式)溶液变成红色。要除去FeCl3溶液中少量的氯化亚铁,可行的办法是??(填字母)。
a.加入铜粉? b.加入铁粉? c.通入氯气? d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式??。
(4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 ?。
(5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是??(填字母)
a.铜粉? b.氯气? c.铁粉? d.KSCN溶液
参考答案:(8分)(1)还原(1分);?(2)还原(1分);
(3)KSCN (1分)? c (1分)
2Fe2++Cl2==2Fe3++2Cl?(1分)
(4)2Fe3++Cu2+==2Fe2++Cu2+(1分)
(5)c (2分)
本题解析:(1)在A中铁元素的化合价由+2价升高到+3价,铁元素的化合价升高,则A中Fe2+做还原剂。
(2)由信息维生素C可使食物中的三价铁离子还原成二价铁离子,该反应中铁元素的化合 价降低,则维生素C中某元素的化合价升高,即维生素C为还原剂,体现还原性。
(3)Fe3+和KSCN溶液发生特征反应,反应后溶液呈红色。氯化亚铁被强化剂氧化呈氯化铁,故选c。离子方程式为2Fe2++Cl2==2Fe3++2Cl?。
(4)FeCl3 与金属铜发生氧化还原反应,铜溶解,反应的离子方程式为2Fe3++Cu2+==2Fe2++Cu2+。
(5)铁的活泼性大于铜的活泼性,置换出铜一般用铁,故选c。
点评:本题属于信息习题,考查氧化还原反应中氧化剂、还原剂及氧化性、还原性,明确元素的化合价变化来分析是解答本题的关键,难度中等。
本题难度:一般
5、选择题 (NH4)2SO4在强热条件下发生分解,生成NH3、SO2、N2和H2O。该反应的生成物中氧化产物和还原产物的物质的量之比是(?)
A.1∶3
B.3∶1
C.3∶4
D.4∶3
参考答案:A
本题解析:N2是氧化产物,SO2是还原产物则:
 失去电子3e-×2=6e-
失去电子3e-×2=6e-
 得到电子2e-×3=6e-
得到电子2e-×3=6e-
故N2与SO2的物质的量之比为1∶3。
本题难度:简单