|
高中化学必备知识点《物质的分离、提纯》高频试题强化练习(2017年最新版)(二)
2017-07-18 00:00:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将下列各分离物质方法的代表字母,填在各小题末的横线上:
A.过滤法;
B.结晶法;
C.分液法;
D.萃取分液法;E.蒸馏法;
| (1)除去食盐水中的泥沙_____________?(2)除去植物油中的水_______________
(3)将溶液中的硝酸钾与氯化钠分离____________
(4)将自来水制为纯净水______________
参考答案:(1)A?(2)C?(3)B ?(4)E
本题解析:食盐水中的泥沙为固态,用过滤法除去;植物油中的水不溶于油,故用分液法除去;将溶液中的硝酸钾与氯化钠随着温度的升高,溶解度不同而析出晶体进行分离;自来水制为纯净水需要蒸馏。
点评:本题考查物质的分离方法,难度不大,考生要注意不同分离方法适用的条件,从而准确作答。
本题难度:一般
2、简答题 为下列混合物的分离或提纯提供正确的方法:
(1)分离饱和食盐水和沙子的混合物______;
(2)分离水和汽油的混合物______;
(3)分离四氯化碳(沸点为76.75℃)和甲苯(有机溶剂,与CCl4互溶.沸点为110.6℃)的混合物______;
(4)从碘的水溶液里提取碘______;
(5)从食盐水中提取氯化钠______.
参考答案:(1)沙子不溶于水,可用过滤法分离沙子和溶液,故答案为:过滤;
(2)水和汽油互不相溶,可用分液的方法分离,故答案为:分液;
(3)二者沸点不同,可用蒸馏的方法分离,故答案为:蒸馏;
(4)碘易溶于有机溶剂,可用苯、四氯化碳等有机溶剂萃取,故答案为:萃取;
(5)可用蒸发的方法得到溶质固体,故答案为:蒸发.
本题解析:
本题难度:一般
3、选择题 下列实验室除杂(括号内为少量杂质)的方案正确的是( )
| 提纯物质 | 除杂试剂 | 提纯方法
A
苯(苯酚)
碳酸钠溶液
过滤
B
Al(Fe)
氢氧化钠溶液
过滤
C
CO2(NO2)
水
洗气
D
乙酸乙酯(乙醇)
水
水洗、分液
|
A.A
B.B
C.C
D.D
参考答案:D
本题解析:
本题难度:简单
4、实验题 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) + Q? (Q > 0 ) NH2COONH4(s) + Q? (Q > 0 )
(1)如用如图装置制取氨气,你所选择的试剂是?。

制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。
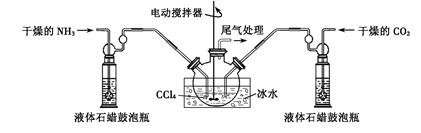
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是___________ __?_。
(3)液体石蜡鼓泡瓶的作用是_______。
(4)从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干? b. 高压加热烘干? c. 真空40 ℃以下烘干
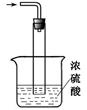
(5)尾气处理装置如图所示。双通玻璃管的作用:________?;浓硫酸的作用:?、______________?_。
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为
___________。(精确到2位小数)
参考答案:(1) 浓氨水与生石灰(氢氧化钠固体等) (2分,合理即给分)
(2)降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解)(2分)
(3) 通过观察气泡,调节NH3与CO2通入比例 (1分)
(4)过滤? c(各1分,共2分)
(5)防止倒吸;吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解(各1分,共3分)
(6)0.80或80%(有效数字没有考虑扣1分)?(2分)
本题解析:(1)由于氨水中存在平衡关系NH3+H2O NH3·H2O NH3·H2O NH4++OH-,所以要利用浓氨水制备氨气,可以把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热且溶液中c(OH-)增大,使浓氨水分解生成氨气。 NH4++OH-,所以要利用浓氨水制备氨气,可以把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热且溶液中c(OH-)增大,使浓氨水分解生成氨气。
(2)反应2NH3(g)+CO2(g) NH2COONH4(s)+Q是放热反应,降低温度平衡向正反应方向进行,有利于氨基甲酸铵上网生成。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。 NH2COONH4(s)+Q是放热反应,降低温度平衡向正反应方向进行,有利于氨基甲酸铵上网生成。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。
(3)因为气体参与反应的不易控制反应速率和用量,所以液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,即通过观察气泡,调节NH3与CO2通入比例。
(4)制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小,其晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,所以答案选c。
(5)氨气易溶于水,所以需要有防倒吸装置,双通玻璃管的作用是防止液体倒吸;氨气是碱性气体,浓硫酸是强酸,且具有吸水性,所以浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解。
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。该物质是碳酸钙,其物质的量为1.000g÷100g/mol=0.010mol。设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳原子守恒得到;x+y=0.01,又因为78x+79y=0.7820,解得x=0.008mol、y=0.002mol,则样品中氨基甲酸铵的物质的量分数= ×100%=80%。 ×100%=80%。
本题难度:困难
5、选择题 下列实验操作有错误的是( )
A.用CCl4萃取溴水中的溴分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏中,冷却水应从冷凝管的下口通入,上口流出
C.用焰色反应检验Na+时,用玻璃棒蘸取试样置于火焰上灼烧观察火焰颜色
D.蒸发结晶时,当加热到有大量固体出现时停止加热,用余热蒸干
参考答案:A.为防止液体重新污染,分液时分液漏斗下层液体从下口放出,上层液体从上口倒出,故A正确;
B.为充分冷凝,使水充满冷凝管,应从冷凝管的下口通入,上口流出,故B正确;
C.玻璃中含有Na元素,影响实验结果,应用铂丝或铁丝,故C错误;
D.蒸发不能直接蒸干,防止温度过高而导致固体分解,应当加热到有大量固体出现时停止加热,用余热蒸干,故D正确.
故选C.
本题解析:
本题难度:简单
|