微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5 ∶6,则甲、乙两烧杯中的反应情况可能分别为( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
参考答案:D
本题解析:
正确答案:D
3H2SO4+2Al=Al2(SO4)3+3H2
那么1molH2SO4对应2/3mol铝原子
2NaOH+2Al+2H2O=?2NaAlO2+H2
那么1molNaOH对应1mol铝原子
因为等物质的量,所以碱等物质的量要比硫酸溶解的铝要多。所以酸都过量,碱肯定也过量,相反,只要碱不足,酸更不足。下面用极值法来分析:
如果酸过量,那么碱肯定过量,(碱只需要消耗1mol就能溶解1mol铝),那么产生的氢气比是1:1,因为还原剂铝完全反应对应的氢气是一样的1:1
如果碱不足,那么酸肯定不足,那么产生的H2比例就是1mol氢氧根对应1mol铝对应1.5molH2,而1mol硫酸分子对应1mol氢气H2.所以产生氢气的比例就是2:3,
实际比例5:6,介于两者之间,那么肯定是碱过量,酸不足。D正确。
本题难度:一般
2、填空题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式__________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是___________。
①硫酸铝和氢氧化钠②硫酸铝和氨水③硫酸锌和氢氧化钠④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因____________________________。
参考答案:(1)AlO2-或Al(OH)4-
(2)Zn+2NaOH = Na2ZnO2+H2↑ 或Zn+2NaOH+2H2O = Na2Zn(OH)4+ H2↑
(3)①③④
(4)Al3++3NH3·H2O = Al(OH)3↓ +3NH4+ ;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制
本题解析:
本题难度:一般
3、填空题 (8分)在50mL bmol·L-1的AlCl3溶液中加入50mL amol·L-1 NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为__________mol。
(2)当a、b满足_________条件时,无沉淀产生。
(3)当a、b满足_________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为_______克。
参考答案:(1)a/60?(2)a≥4b?(3)3b<a<4b;3.9(4b-a)
本题解析:略
本题难度:简单
4、选择题 甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.实验过程中甲中和乙中的现象始终保持一致
参考答案:B
本题解析:氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,但不能溶于氨水中,所以如果氢氧化钠过量,则氢氧化铝就会溶解,因此正确的答案选B。
本题难度:一般
5、计算题 有2 g镁铝合金,与足量的HCl反应,生成气体2.24 L,求该合金中镁、铝的质量百分比。
参考答案:镁、铝的质量比为2∶3
本题解析:本题可以按常规方法设未知数列方程求解,也可由十字交叉法。
用十字交叉法求解:
由2.4 g Mg可生成2.24 L H2,1.8 g Al可生成2.24 L H2,合金2 g生成2.24 L H2得:
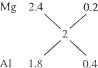

所以m(Mg)∶m(Al)=(1×2.4)∶(2×1.8)=2∶3
特别注意:1∶2不是n(Mg)∶n(Al),而是质量为2.4 g的Mg和质量为1.8 g的Al的份数比。
本题难度:简单