微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的______(填写序号).
①温度②浓度③容量④压强⑤酸式或碱式⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)______.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:______mL(计算结果保留一位小数).
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:______.
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏小(填写字母)______.
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
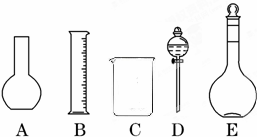
参考答案:(1)A为平底烧瓶、D为分液漏斗,在配制溶液过程中不会使用到烧瓶和分液漏斗;配制一定浓度的溶液还缺少玻璃棒和胶头滴管,
故答案为:AD;玻璃棒、胶头滴管;
(2)容量瓶为定量仪器,容量瓶上标有温度、容量和刻度线,所以①③⑥正确,
故答案为:①③⑥;
(3)配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为:BDAFEC,
故答案为:BDAFEC;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的浓度为:1000×1.84×98%98mol/L=18.4mol/L;实验室没有450mL的容量瓶,实际上配制的是500,mL 0.5mol/L的硫酸,需要浓硫酸的体积为:0.5mol/L×0.5L18.4mol/L≈0.0136L=13.6mL,
故答案为:13.6;
(5)稀释浓硫酸时必须将浓硫酸加入水中,正确的操作方法为:将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌,
故答案为:将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌;
(6)A.用量筒量取浓硫酸时,仰视量筒的刻度,导致量取的浓硫酸体积偏大,配制的溶液浓度偏高,故A错误;
B.容量瓶未干燥即用来配制溶液,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故B错误;
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容,热的溶液体积偏大,冷却后体积变小,配制的溶液体积偏小,根据c=nV,溶液浓度偏高,故C错误;
D.往容量瓶转移时,有少量液体溅出,配制的溶液中溶质的物质的量偏小,根据c=nV,配制的溶液浓度偏低,故D正确;
E.在容量瓶中定容时俯视容量瓶刻度线,导致加入的蒸馏水体积低于容量瓶刻度线,配制的溶液体积偏小,根据c=nV,溶液的浓度偏高,故E错误;
F.烧杯未进行洗涤,导致配制的溶液中溶质的物质的量偏小,根据c=nV,配制的溶液浓度偏低,故F正确;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,配制的溶液体积偏大,根据c=nV,溶液的浓度偏低,故G正确;
故答案为:DFG.
本题解析:
本题难度:一般
2、填空题 用18mol/L?的浓硫酸配制100mL?3.0mol/L?稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解? ④检漏、转移、洗涤?⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______(用下列编号填空).
A.10ml?B.25ml?C.50ml?D.100ml
(2)第③步实验的操是______.
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线______;改用______向容量瓶中滴加蒸馏水至______为止.塞紧瓶塞,倒转摇匀并装试剂瓶.
(4)转移溶液和直接加蒸馏水于容量瓶中要注意“两靠”:一靠是盛溶液的烧杯口靠在玻璃棒上部,二靠是玻璃棒下端靠在______.
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”、“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水______;
②所用过的烧杯、玻璃棒未洗涤______;
③加水超过刻度线后,用胶头滴管吸出多余的液体______.
参考答案:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,
所以xmL×18mol/L=100mL×3.0mol/L,解得:x≈16.7,所需浓硫酸的体积为16.7mL.
根据提供的量筒规格,所以应选择25mL量筒.
故答案为:16.7mL;B.?
(2)浓硫酸稀释操作:把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌使其散热,防止溶液飞溅而烫伤操作者;
故答案为:把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌;
(3)定容操作为:继续向容量瓶加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀;
故答案为:1~2cm处,胶头滴管,液面和刻度线相切;
(4)玻璃棒下端靠在容量瓶瓶颈刻度线以下的内壁上,防止溶液溅出而导致浓度偏小,
故答案为:容量瓶瓶颈刻度线以下的内壁上;
(5)①.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
②烧杯、玻璃棒未进行洗涤,少量硫酸沾在烧杯壁与玻璃棒上,移入容量瓶中硫酸的实际物质的量减小,所配溶液浓度偏小;
③加水超过刻度线后,用胶头滴管吸出多余的液体,导致溶质偏小,配制溶液的浓度偏小;
故答案为:无影响,偏小,偏小.
本题解析:
本题难度:简单
3、简答题 Ⅰ.下列实验方案不可行的是:______
A.用品红溶液鉴别CO2和SO2气体?B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液?D.用NH3和H2O做喷泉实验
E.除去?N2?中少量的O2用灼热的铜网?F.所有剩余的药品都不能放回原瓶
G.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe?SO4溶液液面以下
Ⅱ.实验室制配0.5mol/L的NaOH溶液500mL.
(1)配制时,一般可分为以下几个步骤:①称量?②计算?③溶解?④摇匀⑤转移?⑥洗涤?⑦定容?⑧冷却.其正确的操作顺序为______.
(2)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
②某同学观察液面的情况如右图所示,则所配置的溶液的浓度______.
(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.
参考答案:Ⅰ.A.因SO2气体能使品红溶液褪色,而CO2气体不能使品红溶液褪色,故A错误;
B.因铜与放浓硝酸在常温下反应,所以不能用铜制容器盛放浓硝酸,故B正确;
C.因玻璃塞中二氧化硅与NaOH溶液发生反应生成硅酸钠,从而使玻璃塞和瓶口黏结在一起,所以放NaOH溶液的试剂瓶用橡皮塞,故C正确;
D.因NH3极易溶于H2O,所以NH3和H2O可做喷泉实验,故D错误;
E.因铜能与O2反应生成氧化铜,与N2不反应,所以可用灼热的铜网除去N2中少量的O2,故E错误;
F.因有些药品(如:钠等)用剩后要放回原瓶,故F正确;
故选:BCF;
Ⅱ.(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,故答案为:②①③⑧⑤⑥⑦④;
(2)①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,滞留在刻度线以上的溶液会下落,溶液的体积偏大,浓度偏小,故答案为:偏低;
②定容时俯视观察液面,溶液的体积偏小,浓度偏大,故答案为:偏高;
(3)设稀释后溶液中NaOH的物质的量浓度为xmol/L,根据溶液稀释前后溶质质量不变则,0.5mol/L×0.05L=xmol/L×0.1L,解得x=0.25,故答案为:0.25mol/L.
本题解析:
本题难度:一般
4、选择题 配制一定物质的量浓度溶液时,能使所配溶液的浓度偏高的原因是( )
A.没有用水冲洗烧杯2-3次
B.溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
C.定容时俯视液面使与刻度线相切
D.定容时仰视液面使与刻度线相切
参考答案:C
本题解析:
本题难度:一般
5、选择题 实验室配制1mol/L 250mL NaCl溶液,下列仪器中不需要的是( )
A.玻璃棒
B.分液漏斗
C.胶头滴管
D.250mL容量瓶
参考答案:配制1mol/L250mLNaCl溶液,配制步骤有:计算、称量、稀释、移液、洗涤移液、定容、摇匀等操作;一般用天平称量氯化钠质量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以需要的仪器为:天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
不需要的仪器是分液漏斗,
故选B.
本题解析:
本题难度:简单