| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《物质的量》试题巩固(2017年最新版)(六)
参考答案:C 本题解析:0.5L 1mol/L FeCl3溶液中Cl-的物质的量是0.5L×1mol/L×3=1.5mol;0.2L1mol/L KCl溶液中的Cl-的物质的量是0.2L×1mol/L=0.2mol,离子数目之比等于物质的量之比,所以二者的Cl-的数目之比是1.5mol:0.2mol=15:2,答案选C。 本题难度:一般 2、选择题 设NA表示阿伏加德罗常数的值,下列说法错误的是 |
参考答案:B
本题解析:32gO2和O3的混合气体氧元素的质量为32g,氧原子的物质的量为:32g÷16g/mol=2mol,个数为2NA,A正确;氯气和水反应的方程式为:Cl2 +H2O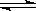 HCl + HClO,由于反应是可逆反应,有多少氯气反应无法确定,故无法计算转移的电子数,B错误;.标准状况下,11.2LSO2的物质的量为11.2L÷22.4L/mol=0.5mol,分子数为0.5NA,C正确;23g钠的物质的量为1mol,Na反应后变为Na+,一个钠原子反应失去一个电子,则1molNa反应失去的电子为1mol,个数为NA,D正确,选B。
HCl + HClO,由于反应是可逆反应,有多少氯气反应无法确定,故无法计算转移的电子数,B错误;.标准状况下,11.2LSO2的物质的量为11.2L÷22.4L/mol=0.5mol,分子数为0.5NA,C正确;23g钠的物质的量为1mol,Na反应后变为Na+,一个钠原子反应失去一个电子,则1molNa反应失去的电子为1mol,个数为NA,D正确,选B。
考点:阿伏伽德罗常数的应用。
本题难度:一般
3、选择题 下列说法不正确的是
A.在标准状况下,NA个任何分子所占的体积约为22.4L
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:l
C.在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L
D.磷酸的摩尔质量(以g/mol为单位)与6.02×1023个磷酸分子的质量(以g为单位)在数值上相等
参考答案:A
本题解析:A不正确,只有是气体才能满足,其余都是正确的,答案选A。
本题难度:一般
4、计算题 60 mL盐酸溶液和40 mL NaOH溶液,两者的溶质的物质的量浓度相等。若混合后溶液中H+的物质的量浓度为0.1 mol·L-1,则两溶液混合前溶质的物质的量浓度为多少?(假定混合体积为100 mL)
参考答案:两溶液混合前溶质的物质的量浓度 为0.5 mol·L-1。
本题解析:混合后溶液的H+的物质的量为n(H+)="0.1" mol·L-1×0.1 L="0.01" mol
HCl+NaOH NaCl+H2O
NaCl+H2O
x·0.06 L-0.01 mol=x·0.04 L
x=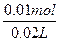 ="0.5" mol·L-1。
="0.5" mol·L-1。
本题难度:简单
5、选择题 设阿伏加德常数为NA。则下列说法正确的是
A.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温常压下,18g H2O中含有的电子数为3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
参考答案:A
本题解析:A.2.7g铝的物质的量为0.1mol,一个铝原子在反应中失去3个电子,所以2.7g铝与足量的盐酸反应,失去的电子数为0.3NA,A错误;B. 0.3mol二氧化硫中含有氧原子数为0.6NA[,B错误;C.H2O是10电子分子,18g H2O中含有的电子数为NA,C错误;D. MgCl2溶液中,Mg2+会水解导致离子数减少,D错误;选A。
考点:考查阿伏伽德罗常数的计算。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《能量的相互.. | |