| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《化学平衡常数》考点强化练习(2017年押题版)(二)
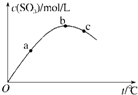 参考答案:C 本题解析: 本题难度:简单 2、选择题 向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( ) |
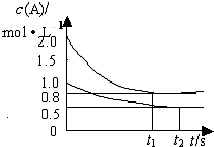
参考答案:A
本题解析:
本题难度:简单
3、选择题 Li3N可以作为一种新型无机储氢材料,其储氢原理可表示为:
Li3N(s)+H2 (g) Li2NH(s) +LiH(s)①
Li2NH(s) +LiH(s)①
Li2NH(s)+H2(g)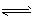 LiNH2(s)+LiH(s)②
LiNH2(s)+LiH(s)②
下列有关说法正确的是
[? ]
A.此法储氢和钢瓶储氢的原理相同
B.储氢过程中两反应的平衡常数相同
C.若两反应中生成等量的LiH,则转移电子数之比为1:2
D.反应中涉及的3种单核离子的半径大小为N3- >Li+ >H-
参考答案:B
本题解析:
本题难度:简单
4、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应: ①NH4I(s)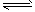 NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g) 达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
[? ]
A.9
B.16
C.20
D.25
参考答案:C
本题解析:
本题难度:一般
5、简答题 合成氨工业的反应为:N2(g)+3H2(g)?2NH3(g);△H<0工业合成氨生产示意图如图1所示.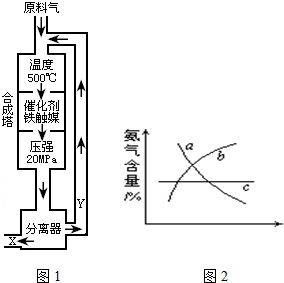
(1)写出该反应的化学平衡常数表达式:K=______.随着温度升高,K值______(填增大、减小、不变)
(2)Y的主要成分为______;
(3)化工生产条件选定的主要原因是(选填字母序号)______;
A.温度、压强对化学平衡的影响;
B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制.
(4)改变反应条件,会使平衡发生移动.如图2象表示随条件改变,氨气的百分含量的变化趋势.
当横坐标为压强时,变化趋势正确的是(选填字母序号)______,
当横坐标为温度时,变化趋势正确的是(选填字母序号)______.
(5)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率.某工厂测得合成塔中N2、H2的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体密度为0.693g/L.则该合成氨厂N2的转化率为多少?______.
参考答案:(1)根据平衡常数的书写要求,该反应的化学平衡常数表达式K=c2(NH3)c(N2)c3(H2),温度升高,平衡逆向移动,c(NH3)减小,c(N2)、c(H2)增大,所以平衡常数减小,故答案为:c2(NH3)c(N2)c3(H2),减小;
(2)Y的主要成分为NH3分离后的N2、H2,故答案为:N2、H2;
(3)若要加快化学反应速率及平衡正向移动,应选择高温、高压、催化剂,但催化剂铁触媒在500℃时活性最大,加压有利于平衡正向移动,但对动力、材料、设备等条件要求高,所以压强不能太大,故答案为:BC;
(4)当横坐标为压强时,因为增大压强,平衡正向移动,NH3含量增大,变化趋势正确的是b,当横坐标为温度时,因为反应正向放热,升温,平衡逆向移动,NH3含量降低,变化趋势正确的是a,故答案为:b,a?
(5)设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1-x),依题意得:
? 28x+2(1-x)=0.5536×22.4? 解得x=0.4
? 所以N2、H2的物质的量之比为2:3
设起始N2的物质的量为2mol,H2为3 mol,N2的转化量为y
?N2 +3H2 ?2NH3
?2?3? 0
?y?3y? 2y
?2-y? 3-3y? 2y
总物质的量=2-y+3-3y+2y=(5-2y)mol
(28×2+2×3)(5-2y)=0.693×22.4(左右都是反应后气体的摩尔质量)
? y=0.5 mol
所以N2的转化率为0.52×100%=25%,故答案为:25%.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《元素周期律.. | |