微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 含有1mol HNO3的稀硝酸分别与不同物质的量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是

A.a是Fe(NO3)2
B.n1=0.375
C.p=0.20
D.n2=0.30
参考答案:D
本题解析:向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3,故AB错误;C选项,Fe(NO3)3与过量的铁继续反应生成? Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe="3" Fe(NO3)2,P点为 Fe(NO3)3与 Fe(NO3)2物质的量相等的点,设生成的? Fe(NO3)2物质的量xmol,则利用方程式可求得x=0.15,即P=0.15,故C错误;D选项,再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)3),所以 n(Fe)=0.3mol即n2=0.3mol,故D正确。
本题难度:一般
2、选择题 下列说法中正确的是?( ?)
A.铁的摩尔质量就是铁的相对原子质量
B.CO32-的摩尔质量是60g/mol
C.1molO2的质量是32g/mol
D.CO2的摩尔质量是44g
参考答案:B
本题解析:A错,摩尔质量在数值上等于该粒子的相对原是;B正确;C错,1molO2的质量是32g;D错,CO2的摩尔质量是44g/mol;
本题难度:一般
3、选择题 .NA表示阿伏德罗常数,下列叙述正确的是:
A.常温常压下,32g氧气所含的原子数目为2NA
B.标准状况下,22.4LH2O含有的分子数为1NA
C.5.6gFe和足量的盐酸反应时,失去的电子数为0.2NA
D.0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
参考答案:AC
本题解析:
正确答案:AC
A、正确,32g氧气为1molO2, 原子数目为2NA
B.不正确,标准状况下, H2O为液体
C.正确,5.6gFe为0.1mol,和足量的盐酸反应时,失去的电子数为0.2NA?
D.不正确,0.5mol/L的MgCl2溶液中,含有Cl-个数无法计算,缺少体积A
本题难度:一般
4、计算题 (10分)将体积为100 mL浓度为2.0 mol?L?1 的CuSO4溶液和体积为300 mL浓度为1.0 mol?L?1 的H2SO4溶液混合,假定混合后溶液体积为400 mL。计算:
(1)混合液中CuSO4的物质的量浓度是?,H2SO4的物质的量浓度是?。
(2)往混合液中加水稀释至Cu2+ 浓度为0.2 mol?L?1,则稀释后溶液的体积为?。
(3)稀释后溶液中H+ 的物质的量浓度是?,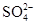 的物质的量浓度是?。
的物质的量浓度是?。
参考答案:(1) 0.5 mol?L?1? 0.75 mol?L?1?(2)1000mL? (3)0.6 mol?L?1? 0.3 mol?L?1
本题解析:(1)n(CuSO4)=0.2mol? n(H2SO4)=0.3mol,混合后溶液的体积为400mL,所以c(CuSO4)=0.5mol/L? c(H2SO4)=0.75mol。
(2)根据c(稀)V(稀)=c(浓)V(浓)有0.2 mol?L?1×V=0.5mol/L×400mL,则V=1000mL。
(3)n(H+)=0.6mol? n(SO42-)=0.3mol,溶液体积为1L,则c(H+)=0.6mol/L,c(SO42-)=0.3mol/L。
点评:本题很基础,难度小,适合于训练学生的基础能力。
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下,3.36L丁烷中含有的碳碳键数为0.6NA
D.在1L 0.2mol·L-1的硫酸铁溶液中含有的铁离子数为0.6NA
参考答案:A
本题解析:A 正确
B 错误,没有标明标况
C 错误,含有的碳碳键数为0.45NA
D 错误,铁离子水解,含有的铁离子数小于0.4NA
本题难度:一般