微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在20g密度为d g/cm3的硝酸钙溶液里含1gCa2+,则硝酸根离子的物质的量浓度是( )
A.
mol?L-1
B.mol?L-1
C.1.25dmol?L-1
D.2.5dmol?L-1
参考答案:1g钙离子的物质的量为1g40g/mol=0.025mol,所以溶液中n(NO3-)=2n(Ca2+)=0.05mol,
溶液的体积为20g1000dg/L=150dL,
故NO3-的物质的量浓度为0.05mol150dL=2.5dmol/L,
故选D.
本题解析:
本题难度:简单
2、选择题 在同温同压下,若A、B两种气体的密度相等,则A和B一定相等的是(?)
A.质量?B.体积?C.分子数?D.摩尔质量
参考答案:D
本题解析:根据阿伏加德罗定律及其推论可知,在相同条件下气体的密度之比是相应的摩尔质量之比,答案选D。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力。该题的关键是熟练记住阿伏加德罗定律以及推论的内容以及适用范围,然后灵活运用即可。
本题难度:一般
3、计算题 (6分)(1)科学研究表明,由于大量使用氟利昂使南极上空的臭氧层出现空洞。臭氧的化学式为O3。在同温同压下,相同质量的O2和O3的物质的量比为 ,
(2)HCl气体极易溶于水,若向水中通入标准状况下的44.8LHCl气体配成1L盐酸,所得盐酸的物质的量浓度为 ;取此盐酸250mL与小苏打(NaHCO3)反应,请计算最多可以产生二氧化碳的体积 (标准状况)。
参考答案:(1)3:2 (2)2.0mol/L 11.2 L
本题解析:(1)根据n=m/M可知,相同质量的物质,其物质的量之比与摩尔质量成反比,故相同质量的O2和O3的物质的量比为48g/mol:32g/mol=3:2;(2)n(HCl)=44.8L÷22.4L/mol=2mol,c=2mol÷1L=2mol/L,设生成的CO2物质的量为n mol
HCl+NaHCO3=NaCl+CO2↑+H2O
1 1
2mol/L×0.25L n 得n ="0.5" mol, V(CO2)=n×22.4L/mol=11.2L。
考点:考查物质的量及在化学方程式中的应用。
本题难度:一般
4、选择题 等物质的量的SO2和SO3相比较,下列结论错误的是( )?
A.它们的分子数目之比为1∶1?
B.它们的质量之比为1∶1?
C.它们的氧原子数目之比为2∶3?
D.它们所含原子数目之比为3∶4
参考答案:B?
本题解析:物质的物质的量之比等于其分子数之比,相同物质的量的两种物质质量之比等于其摩尔质量之比。
本题难度:简单
5、实验题 (8分)用18mol/L的浓硫酸配制100mL 1mol/L硫酸:
(1)用量筒量取浓硫酸的体积应为?mL,将浓硫酸缓缓倒入盛水的烧杯中后__? __?(填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有: A.100mL量筒? B.托盘天平? C.玻璃棒? D.50mL容量瓶 E.10mL量筒? F. 胶头滴管? G. 50mL烧杯? H. 100mL容量瓶
验时应选用的仪器有(填入编号)?。
(3)定容时,若俯视液面,则所配溶液浓度? ____?(填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应?。
A.用胶头滴管将多余溶液吸出? B.加热容量瓶使水挥发? C.重新配制
参考答案:(8分)①5.6(2分),不应(1分)
②C E F G H(2分,漏选得1分,有错选不得分)? ③偏高(1分),C(2分)
本题解析:(1)18mol/L的浓硫酸配制100mL 1mol/L硫酸需要浓硫酸的体积是
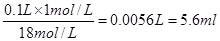 ;量取浓硫酸的量筒是不能洗涤的,否则浓度偏大。
;量取浓硫酸的量筒是不能洗涤的,否则浓度偏大。
(2)量取5.6ml浓硫酸需要10ml量筒,另外还需要稀释浓硫酸额烧杯和玻璃棒,以及100ml容量瓶和定容时需要的胶头滴管,即答案选C、E、F、G、H。
(3)根据c=n/V可知,如果定容时,俯视液面,则容量瓶中溶液的体积减少,所配溶液浓度偏高。若不小心加水超过了容量瓶刻度线,则只能是重新配制,答案选C。
配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。
本题难度:简单