| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》高频考点预测(2017年最新版)(八)
参考答案:B 本题解析:A、c(Na+)=0.4mol·L-1;B、c(Na+)=0.3×3mol·L-1=0.9mol·L-1;C、c(Na+)=0.3×2mol·L-1=0.6mol·L-1;D、c(Na+)=0.5mol·L-1,综上所述B正确。 本题难度:一般 3、选择题 等物质的量的下列化合物在相应条件下完全分解后,得到O2的质量最多的是 |
参考答案:A
本题解析:设化合物的物质的量均为2mol,则2molKClO3生成3mol氧气;2mol高锰酸钾生成1mol氧气;2mol双氧水生成1mol氧气;2mol氧化汞生成1mol氧气,故答案选A。
考点:氧化还原反应方程式
本题难度:一般
4、填空题 某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
参考答案:(1)否 (1分)CaHCl (2分)
(2)2CaHCl + 2H2O = CaCl2 + Ca(OH)2 + 2H2↑(2分)
取样,加稀HNO3溶解后分成二等份,其中一份加入Na2CO3溶液,得到CaCO3沉淀,称重后求得n(Ca2+);另一份加入AgNO3溶液,得到AgCl沉淀,称重后求得n(Cl-), 用下式即可求得x值: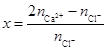 (3分,其它合理答案也给分)
(3分,其它合理答案也给分)
(3)2Cl- + MnO2 + 4H+= Mn2+ + Cl2↑+ 2H2O (2分)
保持FeCl2溶液呈酸性,并加入铁粉防止氧化 (2分)
(4)Ca + CaCl2 = 2CaCl
本题解析:(1)化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,加起来比100%小,表明该物质中还含有氢元素,其质量分数为:100%-52.36%-46.33%=1.31%。因此,可以来确定甲这种物质的化学式:
N(Ca)
本题难度:一般
5、实验题 (20分)以配制250 mL 1mol /L氢氧化钠溶液为例。实验步骤
①计算:需要NaOH固体质量。
②称量:用托盘天平称取___________gNaOH固体,称量时要注意两个问题:一要装在________里称,二要迅速。
③溶解:用量筒量取蒸馏水注入烧杯里,用玻璃棒搅拌。
④冷却:将溶液冷却至室温。
⑤移液:将冷却溶液用_____ 引流到____________ 中。在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
⑥洗涤:用适量蒸馏水洗涤烧杯和玻璃棒_____ 次,并将洗涤液注入容量瓶里。
⑦振荡:手持容量瓶轻轻振荡,使溶液充分混合均匀。
⑧定容:继续加蒸馏水至距刻度线_____ 处,然后,改用____ _ 滴加蒸馏水正好至刻度线。若加水超过刻度线,会造成溶液浓度偏 (高或低),应该 。
⑨摇匀:盖好玻璃塞,反复上下颠倒,使溶液均匀。
参考答案:10.0;小烧杯;玻璃棒;250mL容量瓶;偏低; 2-3次;1-2cm ;胶头滴管;低;重新配制
本题解析:考查一定物质的量浓度溶液的配制。
250 mL 1mol /L氢氧化钠溶液中溶质的物质的量是0.25mol×1mol/L=0.25mol,其质量是0.25mol×40g/mol=10.0g;氢氧化钠易吸水,所以称量时应该放在小烧杯中称量;将溶液转移至容量瓶中需要玻璃棒引流;如果溶液损失,则溶质就减少,因此浓度就偏低;烧杯和玻璃棒都需要洗涤2~3次,关键时洗涤液要注入容量瓶中;当液面接近刻度线1~2cm时,应该用胶头滴管定容;如果加水超过刻度线,则溶液体积偏大,浓度就偏低,此时只能是重新配制。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《原电池原理.. | |