微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是( )
A.CO2的摩尔质量是44 g
B.18 g H2O在标准状况下的体积是22.4 L
C.在标准状况下,20 mL NH3与60 mL O2所含的分子数比为1∶3。
D.将40 g NaOH溶于1 L水中,所得溶液的物质的量浓度为1 mol/L
参考答案:C
本题解析:A、CO2的摩尔质量是44 g/mol,g是质量的单位,错误;B、H2O在标况下为液体,错误;C、氨气和氧气的体积之比为20∶60=1∶3,由阿伏加德罗定律推断,二者的物质的量之比为1∶3,正确;D、溶液的体积应为1L,而非水的体积为1L,错误。
本题难度:一般
2、选择题 设NA为阿伏伽德罗常数的值。下列叙述正确的是?(?)
A.18gNH+4中含有的电子数为10NA
B.78gNa2O2固体中含有的阴离子数为2NA
C.1L0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA
D.标准状况下,2.24L苯含有分子的数目为0.1NA
参考答案:A
本题解析:
A.正确;
B.不正确,O22―过氧根离子是原子团,78gNa2O2固体中含有的阴离子O22―数为NA
C.不正确,醋酸是弱电解质,难电离,1L0.1 mol/L醋酸溶液中含有的氢离子数远小于0.1NA
D.不正确,标准状况下,2.24L苯是液态。
选A。
本题难度:一般
3、选择题 在标准状况下,VL氨气溶于水配成1L密度为ρg/cm3的氨水,该氨水的物质的量浓度为
A.
B.
C.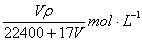
D.
参考答案:D
本题解析:氨气的物质的量 mol,其质量为
mol,其质量为 g,溶液的质量为
g,溶液的质量为 g,溶液的体积
g,溶液的体积 L,氨水的物质的量浓度为
L,氨水的物质的量浓度为
本题难度:简单
4、选择题 等量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述错误的是(?)
A.金属 Al无剩余
B.c (Na+)=c(AlO2-)
C.所得溶液呈碱性
D.Na的物质的量是0.6mol
参考答案:B
本题解析:Na和Al是中学化学常见的金属,Na具有典型的金属性,Al具有典型的过渡性,另外电子守恒计算也是中学化学的重要内容。
n(H2)= =1.2mol,n(Na)=n(Al)=x,根据电子守恒得x+3x=2×1.2mol,x=0.6mol,D正确。
=1.2mol,n(Na)=n(Al)=x,根据电子守恒得x+3x=2×1.2mol,x=0.6mol,D正确。
Al?~? OH-?~? AlO2-
1?1?1
0.6mol?0.6mol?w
w=0.6mol
Al恰好完全反应生成AlO2-,没有剩余,A正确。所得溶液是NaAlO2溶液,由于AlO2-水解知溶液显碱性,而c (Na+)>c (AlO2-),B错,C正确。
本题难度:一般
5、填空题 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

?
| 溶质的物质的量浓度/mol·L-1
| 溶液的密度/g·cm-3
|
硫酸
| c1
| ρ1
|
氨水
| c2
| ρ2
|
?
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
参考答案:(1) (2)c1/2 (3)大于 大于
(2)c1/2 (3)大于 大于
本题解析:解答本题应注意以下三点:
(1)设硫酸体积为1 L进行计算;
(2)注意加水稀释后,可认为是两溶液的体积和;
(3)由图像可知,硫酸的密度逐渐减小,氨水的密度逐渐增大。
本题难度:一般