微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示。下列有关判断正确的是?(?)
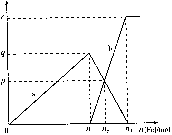
A.a是Fe(NO3)2
B.n1=0.375
C.P=0.125
D.n2=0.30
参考答案:D
本题解析:略
本题难度:一般
2、选择题 铁和铁的合金是生活中常用的材料,下列说法正确的是( )
A.一定条件下,铁粉可与水蒸气反应
B.不锈钢是铁的合金,只含金属元素
C.铁与盐酸反应,铁的合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
参考答案:A
本题解析:A 对,在高温下能反应
B 错不锈钢中还含有非金属元素碳元素
C 错 铁和铁的合金都可与盐酸反应
D 错 镀锌铁板,锌做负极,铁做正极,所以,镀锌铁板比铁板更耐腐蚀
本题难度:简单
3、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
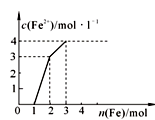
A.2∶1∶4
B.1∶2∶4
C.1∶2∶1
D.1∶1∶4
参考答案:D
本题解析:根据强者优先规则,氧化性强的要先与铁粉反应。
反应顺序为:Fe+4HNO3=Fe(NO3)3+NO+4H2O,此反应消耗1molFe,故有4molHNO3反应,同时生成1molFe(NO3)3。
2Fe(NO3)3+Fe=3Fe(NO3)2,此反应消耗1molFe,故有2molFe(NO3)3反应,但上一步生成了1molFe(NO3)3,故稀溶液中的Fe(NO3)3为1mol。
Cu(NO3)2+Fe=Fe(NO3)2+Cu,该反应消耗1molFe,故有1molCu(NO3)2反应。
同一溶液体系中,各物质的物质的量浓度之比等于物质的量之比,故稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为1∶1∶4
故选D
本题难度:一般
4、选择题 将等质量的铜片在酒精灯上加热后,分别加入下列溶液中,放置片刻,最终铜片质量增加的是( )
A.石灰水
B.无水乙醇
C.硝酸
D.盐酸
参考答案:A
本题解析:先根据铜片在酒精灯上加热生成CuO,质量增加,然后考虑表面的氧化铜与选项中的物质是否反应,确定铜片质量如何变化。
铜片在酒精灯上加热后生成CuO,质量增加,将它投入石灰水中,氧化铜不与石灰水反应,铜片质量增加,故A正确;铜片在酒精灯上加热后生成CuO,质量增加,将它投入无水乙醇中,发生反应:CH3CH2OH+CuO CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3=Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故C错误;与C同理,铜片的质量会减小,故D错误,答案选A。
CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3=Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故C错误;与C同理,铜片的质量会减小,故D错误,答案选A。
点评:该题是中等难度的试题,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑思维能力和抽象思维能力。该题的关键是明确有关物质的化学性质和反应的原理,然后结合题意灵活运用即可。
本题难度:简单
5、填空题 (8分)根据下列流程处理废旧电路板,回收金属M,并制得高效绿色净水剂K2EO4。
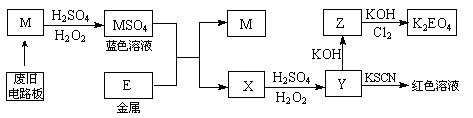
据此回答问题:
(1)M的化学式是?。
 (2)M?MSO4过程中,氧化剂是?,还原剂是?。
(2)M?MSO4过程中,氧化剂是?,还原剂是?。
(3)写出Z→K2EO4的化学反应方程式:?。
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:?。
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
V(M)(x10-3mol.L-1.min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,M的平均溶解速率随着反应温度升高而下降,其主要原因是?。
参考答案:(8分)
(1) Cu(1分)?
(2) H2O2 ,Cu (2分)
(3) 10KOH + 3Cl2 + 2Fe(OH)3 ="=" 2K2FeO4 + 6KCl + 8H2O (2分)
(4) 2Fe3+ + 2I— ="=" 2Fe2+ + I2?(2分)
(5) 过氧化氢分解浓度降低造成速率减慢。(1分)
本题解析:略
本题难度:简单