|
高考化学试题《铁的氧化物》高频考点巩固(2017年模拟版)(八)
2017-07-18 00:47:06
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
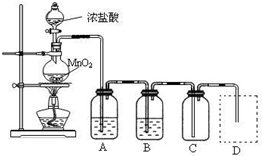
1、简答题 某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
Ⅰ.用下列实验装置制取纯净干燥的氯气
写出A、B中所盛放最佳化学试剂的名称______、______,画出虚线框内所需装置图并标明所需试剂的名称______.
Ⅱ.某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:______;假设③:______.
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空.
?实验方法
实验现象
结论
在溶液中加
KSCN溶液
______
固体物质中有FeCl3
向a溶液中滴加
酸性KMnO4溶液
KMnO4溶液紫色
不褪色
固体物质中不含______
| 由此得出结论:假设______成立(填序号①②③).
Ⅲ.为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是______(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]<Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV.a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式______.活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下:
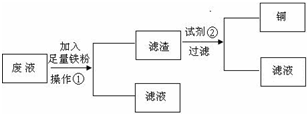
请分别写出操作①和试剂②的名称______,______.
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作______极.当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出.
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:______.
参考答案:Ⅰ、实验室制备氯气含有氯化氢和水蒸气,需要除去得到纯净干燥的氯气,先把气体通入饱和食盐水除去氯化氢,再通入浓硫酸除去水蒸气;剩余氯气有毒污染空气,需要用氢氧化钠溶液吸收,如图为
,故答案为:饱和食盐水;浓硫酸;

;
Ⅱ、(1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3;FeCl3和FeCl2;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2;证明假设①正确;
故答案为:溶液变红色;FeCl2;①;
Ⅲ、a通过实验验证为FeCl3,
A、向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,依据沉淀转化原理,反应向更难溶的分析进行,证明Fe(OH)3溶解度小于Mg(OH)2溶解度;故A正确;
B、铁和三价铁之间反应生成亚铁离子,溶液颜色变化为黄色变化为浅绿色;故B错误;
C、三价铁在沸水中水解生成氢氧化铁胶体,故C错误;
D、溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,灼烧得到Fe2O3固体,故D正确;
故答案为:AD;
IV、三价铁和金属铜之间反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu2+=2Fe3++Cu;依据流程分析①是分离固体和溶液,需要用过滤操作;加入的试剂②是溶解铁需要 稀盐酸或稀硫酸;在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,该反应能证明三价铁的氧化性强于铜离子,根据金属活动顺序表得出Cu2+>H+>Fe2+,电解时,阳极是活泼电极时,则金属电极会溶解,阴极上有少量气泡产生时,说明金属铜做阴极,按照氧化性顺序Fe3+>Cu2+>H+>Fe2+,可以得出放电的离子以及电极反应为:Fe3++e-=Fe2+,Cu2++2e-=Cu,2H++2e-=H2↑,在阳极上放电的是氯离子,产生氯气,有毒,使用了电解装置,成本较高等;
故答案:2Fe3++Cu2+=2Fe3++Cu;过滤;盐酸(或稀硫酸);阴;有污染性气体Cl2产生;使用了电解装置,成本较高等.
本题解析:
本题难度:一般
2、选择题 将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+溶度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2 :3
B.3 :2
C.1 :2
D.1 :1
参考答案:A
本题解析:已反应的Fe3+和未反应的Fe3+的物质的量分别是x和y,则根据方程式可知
2Fe3++Fe=3Fe2+
2mol? 1mol 3mol
x? 1.5x
所以y=1.5x
解得x︰y=2 :3
答案选A
点评:该题是基础性试题的考查,难度不大,主要是考查学生灵活运用基础知识解决问题的能力。该题是常规性计算题的考查,直接根据方程式列式计算即可。
本题难度:一般
3、填空题 (18分)工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO2·5H2O的主要流程如下:

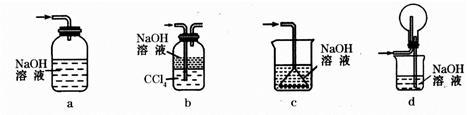
(1)下列装置可用于吸收气体X的是___________(填代号)。
(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为_____________。?
②实验时,依次进行如下操作:组装仪器、__________________、加装药品、通入气体、_____________________、点燃酒精灯。
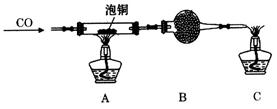
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。?
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
_______________________________________________________________________。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为___________________。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·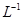 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: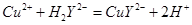 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
参考答案:(1)bd
(2)①碱石灰②检查装置气密性;收集CO检验纯度
(3)取少量熔渣,加过量稀硫酸溶解,然后向滤液中加少量KMnO4溶液,若溶液紫色退去,则说明熔渣中含有FeO
(4)3:2
(5) ;高 ;高
本题解析:(1)气体X是SO2,可用NaOH溶液吸收,注意防止倒吸,故可选用bd;(2)①用泡铜制取粗铜是利用CO与Cu2O反应来得到Cu,同时生成CO2,故装置B干燥管内应放碱石灰;②实验时,依次进行的操作为:组装仪器、检查装置气密性、加装药品、通入气体、收集CO检验纯度、点燃酒精灯;(3)验证熔渣中含有FeO,可以利用亚铁离子的还原性,操作为:取少量熔渣,加过量稀硫酸溶解,然后向滤液中加少量KMnO4溶液,若溶液紫色退去,则说明熔渣中含有FeO;(4)铜不与稀硫酸反应,但可溶解在硝酸中,反应的离子方程式为3Cu+8H++2NO=3Cu2++2NO↑+4H2O,由此可知当硝酸与硫酸物质的量之比为2:3时,硝酸全部转化为NO,此时溶液中溶质为CuSO4,即混酸中H2SO4与HNO3的最佳物质的量之比为3:2;(5)根据所给反应可知n(Cu2+)=n(H2Y2-),所以CuSO4·5H2O的质量分数为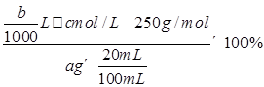 = =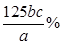 。 。
本题难度:一般
4、计算题 某工厂化验室为测定某黄铁矿(主要成分是FeS2)的纯度,取1.00 g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧,完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成SO3时,SO2的利用率为80%,吸收塔中SO3完全吸收。若煅烧10 .0t上述黄铁矿,则可制得98%的硫酸多少吨?
参考答案:(1)75%(2分);(2)9.8t(2分)
本题解析:略
本题难度:一般
5、填空题 将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
①取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
②另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L;
请根据以上实验中得到的数据分析计算:
⑴?原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
⑵?所得混合溶液中c(Cu2+)的取值范围;
⑶?若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉
或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
参考答案:⑴?原FeCl3溶液中c(FeCl3)=
⑵50.0mL混合溶液中n?(Cu2+)的取值范围为:[0.600?mol/L,1.50?mol/L]
⑶?还可测出50.0mL混合溶液中n?(Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。
本题解析:⑴?解:由I得50.0mL混合溶液中c(Cl-)=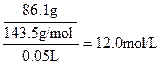 ? ?
所以原FeCl3溶液中c(FeCl3)= ? ?
⑵?解:Ⅱ中加入1.4gFe无固体剩余,即发生的反应为:Fe+2Fe3+=3Fe2+
所以50.0mL混合溶液中至少含有Fe3+: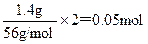 ? ?
Ⅲ中加入20.0mL稀硝酸后产生的气体为NO,反生的反应为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
即50.0mL混合溶液中至少含有Fe2+: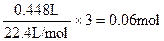 ? ?
50.0mL混合溶液中根据铁元素守恒有:
n?(Fe2+)?+?n?(Fe3+)?=?4.0?mol/L×0.05L=?0.20?mol?
根据电荷守恒有:3n?(Fe3+)+2n?(Fe2+)+2n?(Cu2+)=n?(Cl-)=
当n?(Fe3+)?有最小值时,n?(Fe2+)、n?(Cu2+)有最大值,且由上述两等式可求得
n?(Cu2+)的最大值为0.075?mol?
当n?(Fe2+)有最小值时,n?(Fe3+)?有最大值,n?(Cu2+)有最小值,同样可求得
n?(Cu2+)的最小值为0.03?mol?
所以,50.0mL混合溶液中n?(Cu2+)的取值范围为:[0.600?mol/L,1.50?mol/L]
⑶?解:还可测出50.0mL混合溶液中n?(Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。
本题难度:一般
| 