微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁。下列说法中不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取 MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.以上提取镁的过程中涉及的反应均不是氧化还原反应
参考答案:D
本题解析:①把贝壳制成石灰乳反应为CaCO3 CaO+CO2↑,CaO+H2O=Ca(OH)2. ②Ca(OH)2+ MgCl2 =Mg(OH)2↓+CaCl2. ③Mg(OH)2+2HCl= MgCl2+H2O. ⑤MgCl2
CaO+CO2↑,CaO+H2O=Ca(OH)2. ②Ca(OH)2+ MgCl2 =Mg(OH)2↓+CaCl2. ③Mg(OH)2+2HCl= MgCl2+H2O. ⑤MgCl2 Mg+ Cl2↑.A.由以上化学反应可知制取的原料为贝壳、海水、盐酸。所以原料丰富。正确。B. ①②③步骤的目的是从海水中提取纯净的MgCl2。正确。C. CaCO3
Mg+ Cl2↑.A.由以上化学反应可知制取的原料为贝壳、海水、盐酸。所以原料丰富。正确。B. ①②③步骤的目的是从海水中提取纯净的MgCl2。正确。C. CaCO3 CaO+CO2↑,是分解反应,CaO+H2O=Ca(OH)2是化合反应. Ca(OH)2+MgCl2= Mg(OH)2↓+CaCl2、Mg(OH)2+2HCl= MgCl2+H2O.是复分解反应,MgCl2
CaO+CO2↑,是分解反应,CaO+H2O=Ca(OH)2是化合反应. Ca(OH)2+MgCl2= Mg(OH)2↓+CaCl2、Mg(OH)2+2HCl= MgCl2+H2O.是复分解反应,MgCl2 Mg+ Cl2↑是分解反应。故反应类型正确。D? MgCl2
Mg+ Cl2↑是分解反应。故反应类型正确。D? MgCl2 Mg+ Cl2↑既是分解反应,也是氧化还原反应。所以该选项错误。
Mg+ Cl2↑既是分解反应,也是氧化还原反应。所以该选项错误。
本题难度:一般
2、选择题 离子膜法制烧碱示意图如下图所示,有关说法正确的是? ( )。
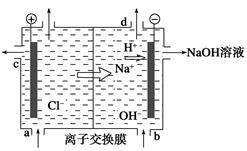
A.a口进水
B.b口进精制饱和食盐水
C.c口出的是Cl-,是由b口进入的
D.d口出的是H2
参考答案:D
本题解析:a口进入的是精制饱和NaCl溶液;b口所进的是含少量NaOH的水;
c口出的是淡盐水;d口出的是H2。
本题难度:一般
3、选择题 我国及美国、日本等国家都已研制出了一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是( )
A.普通硅酸盐陶瓷
B.氮化硅陶瓷?
C.光导纤维
D.玻璃钢
参考答案:B
本题解析:
本题难度:简单
4、填空题 (8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:

在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度= ?× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
?× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式? ?。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为?。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为?。
参考答案:(8分)(1)6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O
(2)14.29%;Fe35(OH)15(SO4)45·54H2O
本题解析:略
本题难度:简单
5、填空题 (12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:

(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式???
②写出水解器中(NH4)2S2O8溶液的水解方程式???。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因???。
④试分析水解器中使用减压水解、蒸馏的原因???。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
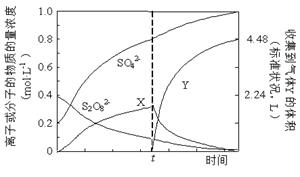
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为???。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式???.
参考答案:(1)①2NH4HSO4 (NH4)2S2O8+H2(2分)
(NH4)2S2O8+H2(2分)
②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2(2分
③铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅(2分)
④减压水解、蒸馏是为了减少双氧水的分解损失。(2分)
(2)①H2O2?(2分)
②2Mn2++5S2O82-+8H2O?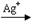 ?2MnO4-+10SO42-+16H+(2分)
?2MnO4-+10SO42-+16H+(2分)
本题解析:(1)电解和水解的反应式均可根据题中所给反应物和生成物书写,可得①2NH4HSO4 (NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2 ,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2 的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O?
(NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2 ,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2 的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O? ?2MnO4-+10SO42-+16H+
?2MnO4-+10SO42-+16H+
点评:本题属于常规工艺流程题,需要利用化学反应原理对生产工艺进行分析,其中涉及的化学原理都是常见化学物质的性质,接下来的小题会涉及不同的知识点来解答,要利用到物质的特殊化学性质,学生应当对这部分知识熟练掌握,最后的图像题,还是将图像信息转化为化学的文字信息来理解。
本题难度:困难