微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NaCl是海水中含量最多的盐,除食用外,它还是海洋化学工业原料,下列以NaCl为原料的产品(或物质)是(?)
①烧碱?②纯碱?③金属钠?④氯气?⑤盐酸
A.全部
B.只有①②③④
C.只有①②③⑤
D.只有①②④⑤
2、选择题 从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。
A.氧化→吸收→吹出
B.氧化→吹出→吸收
C.吹出→氧化→吸收
D.吹出→吸收→氧化
3、选择题 随着社会的进步,复合材料的发展前途越来越好。目前,复合材料最主要的应用领域是?
[? ]
A.高分子分离膜
B.人类的人工器官
C.宇宙航空工业
D.新型治疗药物
4、选择题 阅读下列材料,回答有关问题。
锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡离子有强还原性,+4价铅元素的化合物有强氧化性。例如:Sn2+还原性比Fe2+还原性强。PbO2的氧化性比Cl2氧化性强。
(1)写出下列反应的化学方程式:
①氯气跟锡共热:_____________________________________________________________;
②氯气跟铅共热:_____________________________________________________________;
③二氧化铅跟浓盐酸共热:_____________________________________________________。
(2)能说明Sn2+还原性比Fe2+还原性强的离子方程式是___________________________。
5、填空题 (12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
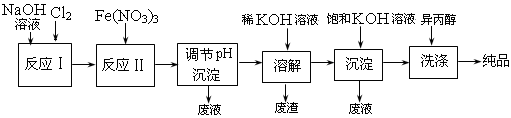
①反应I的化学方程式为 ? 。
②反应II的离子方程式为 ? 。
③加入饱和KOH溶液的目的是 ? 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ? ;? ______?____。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。