微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列水解反应的离子方程式正确的是
A:NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B:CO32-+2H2O H2CO3+
H2CO3+ 2OH-
2OH-
C:CH3COOH+H2O CH3COO-+H3O+
CH3COO-+H3O+
D:CH3 COOH+OH-
COOH+OH- CH3COO-+H2O
CH3COO-+H2O
参考答案:A
本题解析:略
本题难度:一般
2、选择题 常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中
A.c(CH3COO-)= c(Na+)时,醋酸与氢氧化钠恰好完全中和
B.c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,不一定是醋酸过量
C.c(Na+)> c(CH3COO-)> c(OH-)> c(H+)时,一定是氢氧化钠过量
D.c(CH3COO-)= c(Na+)时,该溶液一定呈中性
参考答案:D
本题解析:两者恰好中和时,溶液为醋酸钠溶液,由于CH3COO-水解呈碱性,此时c(Na+)> c(CH3COO-)> c(OH-)> c(H+),故排除AC;
B.当c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,溶液呈酸性,则一定是醋酸过程,否则混合溶液一定呈碱性,排除B
D:溶液中共四种离子,遵循电荷守恒: c(H+)+c(Na+)=c(CH3COO-)+c(OH-),当c(CH3COO-)= c(Na+)时,c(H+)= c(OH-),溶液呈中性
故答案为D
本题难度:一般
3、选择题 下列叙述中,不正确的是? ( )。
A.c(NH4+)相等的(NH4)2SO4和NH4Cl溶液中,溶质浓度大小关系:c[(NH4)2SO4]<c(NH4Cl)
B.向10 mL 0.10 mol·L-1的CH3COOH溶液中加入等物质的量的NaOH后,溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.两种不同浓度的HA溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1≥10c2
D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32—)+c(OH-)
参考答案:B
本题解析:本题综合考查盐类水解、弱电解质的电离等,意在考查考生的综合思维能力。c(NH4+)相等的(NH4)2SO4和NH4Cl溶液中浓度较大的是NH4Cl,故A项正确;B项反应后的溶液中溶质为醋酸钠,因醋酸根水解使溶液呈碱性,故溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);C项,若HA为强酸,则c1=10c2,若HA为弱酸,c1>10c2;由物料守恒与电荷守恒可知D项正确。
本题难度:一般
4、填空题 (10分)
(1)Cu(NO3)2的水溶液呈?(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):______?,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是??。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。
参考答案:(10分)(1) 酸,<,Cu2++ H2O 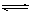 ?Cu(OH)2+ 2H+,抑制
?Cu(OH)2+ 2H+,抑制
(2)酸,Al3++3H2O 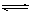 ?Al(OH)3+3H+, Al2O3?(3)NaOH
?Al(OH)3+3H+, Al2O3?(3)NaOH
本题解析:(1)Cu(NO3)2是强酸弱碱盐,铜离子水解,水溶液呈酸性,pH小于7。水解方程式是Cu2++ H2O 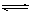 ?Cu(OH)2+ 2H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解。
?Cu(OH)2+ 2H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解。
(2)氯化铝溶于水,铝离子水解,溶液显酸性,水解方程式是Al3++3H2O 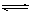 ?Al(OH)3+3H+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝。
?Al(OH)3+3H+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝。
(3)硫化钠溶于水,硫离子水解,溶液显碱性。所以在配制硫化钠溶液时,为了防止发生水解,可以加入少量的氢氧化钠。
考点;考查盐类水解的应用
点评:盐电离出来的离子结合水电离出来的 H+或 OH-生成弱电解质的过程。盐类水解的应用主要有:①判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。②比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。③判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发生强烈双水解,则不能在溶液中大量共存。④配制易水解的盐溶液时,需考虑抑制盐的水解。⑤选择制备盐的途径时,需考虑盐的水解。⑥离子除杂、化肥的使用需考虑盐类的水解。⑦溶液中离子浓度大小比较时需要考虑盐类水解。
本题难度:一般
5、选择题 下列溶液中有关物质的浓度关系正确的是 (?)
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) >c[(NH4)2SO4]>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
参考答案:C
本题解析:A(NH4)2SO4="2" NH4++ SO42-;NH4HSO4= NH4++H++ SO42-;NH4Cl= NH4++Cl-。由于每摩尔的(NH4)2SO4产生2摩尔的NH4+离子,而每摩尔的NH4HSO4、NH4Cl只能产生1摩尔的NH4+离子。所以假如忽略NH4+离子的水解作用,当c(NH4+)相等时,(NH4)2SO4的浓度最小。NH4+离子的水解使溶液显酸性,而NH4HSO4电离产生的H+对NH4+离子的水解起到了抑制作用。c(NH4+)相等时,c(NH4Cl)>c(NH4HSO4)。故A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中: c(NH4Cl)>c(NH4HSO4) >c[(NH4)2SO4]。错误。B.向醋酸钠溶液中加入适量醋酸,CH3COONa=CH3COO-+Na+。由于得到的是酸性溶液则CH3COOH的电离作用大于CH3COO-的水解作用。盐的电离作用大于弱电解质的电离。所以离子浓度的大小关系是:c(CH3COO-) >c(Na+)>c(H+)>c(OH-)。错误。C对于Na2CO3溶液来说,溶液由于水解显碱性。根据质子守恒可得c(OH-)=c(H+)(始)=c(HCO3-)+c(H+)+2c(H2CO3)。正确。D.根据电荷守恒可得在某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-).错误。
本题难度:一般