|
高考化学必考知识点《化学反应与能量》高频考点巩固(2017年模拟版)(八)
2017-07-18 01:00:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
A.0.5 Q
B.Q
C.2 Q
D.5 Q
参考答案:C
本题解析:根据C2H6O+3O2 2CO2+3H2O 2CO2+3H2O
CO2+Ca(OH)2===CaCO3+H2O
则:C2H6O ~ 2CO2~ 2CaCO3~?热量
1 mol? 2 mol? 2×100 g?x
0.5 mol? 1 mol? 100 g?Q
x=Q/0.5=2Q
本题难度:简单
2、选择题 以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是 ( )
A.Q1>Q2>Q3
B.Q1>Q3>Q2
C.Q3>Q2>Q1
D.Q2>Q1>Q3
|
参考答案:A
本题解析:已知①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1 kJ/mol,
②2H2S(g)+O2(g)="2S" (s)+2H2O(l)△H=-Q2 kJ/mol,
③2H2S(g)+O2(g)="2S" (s)+2H2O(g)△H=-Q3kJ/mol,
①与②相比较,由于S→SO2放热,则Q1>Q2,②与③相比较,由于H2O(l)→H2O(g)吸热,则Q2>Q3,
则Q1>Q2>Q3,选A.
考点:考查反应热的大小比较。
本题难度:一般
3、选择题 过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口及环境、食品消毒;实验室一般用过氧化钡(BaO2)与稀硫酸反应来制取。请问,过氧化钡(BaO2)中所含化学键为
A.只有离子键
B.离子键和共价键
C.只有共价键
D.离子键、共价键和氢键
参考答案:B
本题解析:过氧化氢的结构式是H-O-O-H,过氧化钡(BaO2)与稀硫酸反应来制取过氧化氢,这说明过氧化钡中含有非极性键。又因为钡是活泼的金属,属于还含有离子键,即该化合物是离子化合物,没有氢键,答案选B。
点评:该题是高考中的常见考点,主要是考查学生对化学键,以及化学键判断的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的易错点是选项D。
本题难度:简单
4、填空题 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1 6CaO(s)+P4(s)+10CO(g) ΔH1="+3" 359.26 kJ·mol-1
CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1 CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g) ΔH3 6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3= kJ·mol-1。
(2)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2S O3(g) ΔH1="-197" kJ·mol-1; 2S O3(g) ΔH1="-197" kJ·mol-1;
H2O(g) H2O(l) ΔH2="-44" kJ·mol-1; H2O(l) ΔH2="-44" kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) 2H2SO4(l) ΔH3="-545" kJ·mol-1。 2H2SO4(l) ΔH3="-545" kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是 。
(3)大气中的部分碘源于O3对海水中I-的氧化。O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1 IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HIO(aq) ΔH2 HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3 I2(aq)+H2O(l) ΔH3
总反应的化学方程式为 ,其反应热ΔH= 。
参考答案:(1)2 821.6
(2)SO3(g)+H2O(l) H2SO4(l) ΔH="-130" kJ·mol-1 H2SO4(l) ΔH="-130" kJ·mol-1
(3)O3+2I-+2H+ I2+O2+H2O ΔH1+ΔH2+ΔH3 I2+O2+H2O ΔH1+ΔH2+ΔH3
本题解析:(1)ΔH3=ΔH1+6ΔH2="+2" 821.6 kJ·mol-1。(2)ΔH=(ΔH3-ΔH1-2ΔH2)/2="-130" kJ·mol-1。(3)将已知3个热化学方程式连加可得O3+2I-+2H+ I2+O2+H2O,由盖斯定律得ΔH=ΔH1+ΔH2+ΔH3。 I2+O2+H2O,由盖斯定律得ΔH=ΔH1+ΔH2+ΔH3。
考点:化学反应与能量、盖斯定律、热化学方程式的书写
本题难度:一般
5、填空题 按要求写出下列方程
(1)碳酸钠溶液呈碱性的原因,用离子方程表示 。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为: 。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式 。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示 。
(5) Al(OH)3的电离反应方程式: 。
参考答案:(1)CO32-+H2O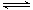 HCO3-+OH- (2)Zn-2e-=Zn2+ HCO3-+OH- (2)Zn-2e-=Zn2+
(3)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
(4)Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ (5)H++AlO2-+H2O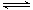 Al(OH)3 Al(OH)3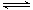 Al3++3OH- Al3++3OH-
本题解析:(1)碳酸钠是强碱弱酸盐,溶于水电离出的CO32-水解,溶液显碱性,离子方程式为CO32-+H2O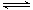 HCO3-+OH-。 HCO3-+OH-。
(2)锌的金属性强于铁,与铁构成原电池时锌是负极失去电子,被氧化。铁是正极,被保护,负极反应式为Zn-2e-=Zn2+。
(3)20.0 g NaOH的物质的量=20.0g÷40.0g/mol=0.5mol,与足量的盐酸反应生成0.5mol水,因此生成1mol水时放出的热量是28.7 kJ×2=57.4kJ。又因为中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol。
(4)氯化铵溶液中NH4+水解溶液显酸性,因此可以溶解氢氧化镁,反应的离子方程式为Mg(OH)2+2NH4+=2NH3·H2O+Mg2+。
(5)氢氧化铝是弱电解质,属于两性氢氧化物存在两种电离平衡,酸式电离和碱式电离,因此其电离方程式为H++AlO2-+H2O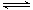 Al(OH)3 Al(OH)3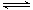 Al3++3OH-。 Al3++3OH-。
考点:考查盐类水解、金属的腐蚀与防护、中和热计算、溶解平衡以及氢氧化铝的电离
本题难度:一般
|