微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”?的有关叙述正确的是(?)
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
参考答案:B
本题解析:A.常温下“纳米铜”比铜片的与氧气的接触面积大,活动性强,反应时反应速率快。错误。B.Cu是固体,把Cu制成“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快。最强。C.“纳米铜”与铜都是Cu元素的同种单质,只是颗粒大小不同而已。错误。D.常温下“纳米铜”比铜片更易失去电子,反应时反应速率快。错误。
本题难度:简单
2、选择题 下列四个试管中发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
| 试管 | 盐酸浓度 | 温度 | 锌的状态
A
0.5mol?L-1
30℃
块 状
B
0.5mol?L-1
30℃
粉末状
C
1mol?L-1
35℃
块 状
D
1mol?L-1
35℃
粉末状
|
A.A
B.B
C.C
D.D
参考答案:对于反应Zn+2HCl=ZnCl2+H2↑来说,盐酸浓度越大,反应温度越高,固体的表面积越大,则反应速率越大,反之越小,
故选A.
本题解析:
本题难度:简单
3、选择题 下列条件下化学反应速率最大的是?
[? ]
A.20℃,0.1mol/L的盐酸溶液20mL与0.5g块状碳酸钙反应 ?
B.10℃,0.1mol/L的盐酸溶液20mL与1g块状碳酸钙反应? ?
C.10℃,0.2mol/L的盐酸溶液10mL与0.5g粉状碳酸钙反应 ?
D.20℃,0.2mol/L的盐酸溶液10mL与0.5g粉状碳酸钙反应
参考答案:D
本题解析:
本题难度:一般
4、简答题 (1)在下列事实中,什么因素影响了化学反应的速率?
①同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢:______.
②同样大小的石灰石分别在0.1mol?L-1的盐酸和1mol?L-1的盐酸中反应速率不同:______.
③煤的燃烧被研得越细越好:______
④实验室用锌和稀硫酸制氢气时在反应液中中少量的五水硫酸铜晶体,冒出气泡明显增加:______
(2)合成NH3反应:N2(g)+3H2(g)

2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol?H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
参考答案:(1)①锌粒和镁块活动性不同,故反应速率不同,故答案为:反应物本身的性质;
②盐酸浓度越大,反应速率越快,故答案为:反应物的浓度;
③把煤研细,增大了与空气的接触面积,故反应速率加快,故答案为:反应物的接触面积;
④原电池反应可使反应速率加快,故答案为:Zn与?CuSO4?反应生成Cu与Zn组成微型原电池(或发生原电池反应).
(2)v(NH3)=z2V?mol?L-1?min-1,则v(N2)=12v(NH3)=12×z2V?mol?L-1?min-1═z4V?mol?L-1?min-1 ?
v(H2)=32v(NH3)=32×z2V?mol?L-1?min-1═3z4V?mol?L-1?min-1.
答:N2、H2、NH3表示的反应速率分别是v(NH3)=z2Vmol?L-1?min-1,v(N2)=z4V?mol?L-1?min-1;v(H2)=3z4V?mol?L-1?min-1.
本题解析:
本题难度:一般
5、填空题 (14分)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)  CH3OH(g)下表为不同温度下的平衡常数(K)
CH3OH(g)下表为不同温度下的平衡常数(K)
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
(1)该反应的平衡常数表达式K= ,ΔH 0(填“>”、“<”或“=”)。
(2)将1 mol的H2和 1 mol 的 CO充入 1 L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,求CO的平衡转化率(写出计算过程)。
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
(填字母)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/ c(CH3OH)减小
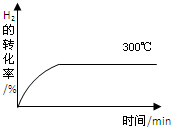
(4)其他条件相同时,在上述三个温度下分别发生该反应。300℃时,H2的转化率随时间的变化如图所示,请补充完成350℃时H2的转化率随时间的变化示意图。
参考答案:(1)K=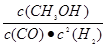 ;< 。
;< 。
(2)c(H2)=c(CO)=1mol/L,恒容密闭反应器中,气体的总体积之比与压强成正比,设CO的平衡转化率为x,利用三段式可求:
2H2(g)+ CO(g)  CH3OH(g)
CH3OH(g)
起始(mol/L) 1 1 0
转化(mol/L) 2x x x
平衡(mol/L) 1-2x 1-x x
根据容器内的压强为开始时的60%可知: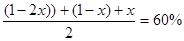 ,求得:x="40%" 。
,求得:x="40%" 。
(3)ACD
(4)
本题解析:(1)该反应的平衡常数表达式K=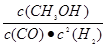 ,根据表中信息可知,升高温度,平衡常数K减小,则反应物的浓度增大,生成物的浓度减小,说明平衡向逆反应方向移动,则反应为放热反应,ΔH<0。
,根据表中信息可知,升高温度,平衡常数K减小,则反应物的浓度增大,生成物的浓度减小,说明平衡向逆反应方向移动,则反应为放热反应,ΔH<0。
(2)c(H2)=c(CO)=1mol/L,恒容密闭反应器中,气体的总体积之比与压强成正比,设CO的平衡转化率为x,利用三段式可求:
2H2(g)+ CO(g)  CH3OH(g)
CH3OH(g)
起始(mol/L) 1 1 0
转化(mol/L) 2x x x
平衡(mol/L) 1-2x 1-x x
根据容器内的压强为开始时的60%可知: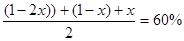 ,求得:x="40%" 。
,求得:x="40%" 。
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,增大压强,正、逆反应速性 率都加快,平衡向正反应方向移动,则n(H2)减少但体积减小一半,故c(H2)增大,A正确, B错误;CH3OH 的物质的量增加,C正确;平衡向正反应方向移动,重新平衡时c(H2)/ c(CH3OH)减小,D正确,故选ACD。
(4)该反应的正反应为放热反应,升高温度,化学反应速率增大,平衡向逆反应方向移动,H2的转化率降低,因此350℃时H2的转化率随时间的变化示意图如下:
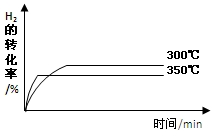
考点:考查化学反应速率、化学平衡的应用及平衡常数的计算。
本题难度:困难