|
高考化学必考知识点《物质的量》高频考点特训(2017年练习版)(四)
2017-07-18 01:05:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA代表阿伏加德罗常数。下列说法正确的是( )
A.9 g中所含质子数为0.5×6.02×1023
B.电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g
C.往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA
D.V L a mol·L
|
参考答案:
本题解析:
本题难度:一般
2、选择题 常温下,向20升真空容器内通入a mol H2S和b mol SO2(a、b均为正整数,且a≤5,b≤5),反应完成后,容器内气体可能达到的最大密度是
?[? ]
A、24.5g/L
B、14.4g/L
C、8g/L
D、5.1g/L
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列溶液中有关物质的量浓度关系正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:[NaOH]<[CH3COONa]<[Na2CO3]
B.Na2CO3溶液中[Na+]与[CO32-]之比为2:1
C.[NH4+]相等的NH4Cl和NH4HCO3、NH4HSO4三种溶液:[NH4HSO4]<[NH4Cl]<[NH4HCO3]
D.橙汁、人体血液、蔗糖溶液、胃液中[H+]依次降低
参考答案:A、强碱弱酸盐,对应酸的酸性越弱,水解程度越大,溶液中溶质的物质的量越小,酸性大小关系为:醋酸>碳酸,所以碳酸钠水解程度大,pH相同时,醋酸钠的浓度大于碳酸钠的浓度;氢氧化钠为强碱,浓度最小,所以pH相同,三者浓度关系为:[NaOH]<[Na2CO3]<[CH3COONa],故A错误;
B、碳酸钠溶液中,由于碳酸根离子发生了水解,物质的量减小,所以[Na+]与[CO32-]之比大于2:1,故B错误;
C、氯化铵属于弱酸弱碱盐、碳酸氢铵属于弱酸弱碱盐,发生双水解,水解程度增大、碳酸氢铵溶液显示酸性,溶液中的氢离子抑制了铵离子水解,所以溶液中铵离子浓度相等,三种溶液浓度满足::[NH4HSO4]<[NH4Cl]<[NH4HCO3],故C正确;
D、血液:7.35~7.45、胃液:0.9~1.5、橙汁显示弱酸性,pH在3.5左右、蔗糖呈中性,所以氢离子浓度为:胃液>橙汁>蔗糖>血液,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 在密闭容器中有H2、O2、Cl2的混合气体。电火花点燃,容器中的三种气体恰好完全反应,冷却到室温后得到液体产物的溶质质量分数是33.6%,则容器中原H2、O2、Cl2的体积比是()
A.2∶1∶1
B.9∶4∶1
C.4∶2∶2
D.9∶4∶3
参考答案:B
本题解析:本题主要考查Cl2和非金属的反应及溶质的质量分数的计算方法。
解法一:常规方法。
设原混合气体中分别含O2体积是x,Cl2体积是y。据题意,当产物中HCl气体溶于生成的水中得到盐酸。由阿伏加德罗定律,V1∶V2=n1∶n2。
2H2+O2 2H2O 2H2O
(2x)?x? (2x)
H2+Cl2 2HCl 2HCl
(y)?y? (2y)
33.6%=2y× ×100%, ×100%,
解得x∶y=4∶1由于V(H2)=2x+y,
则V(H2)∶V(O2)∶V(Cl2)=9∶4∶1。
选B。
解法二:挖潜法。
通过反应方程式2H2+O2 2H2O和H2+Cl2 2H2O和H2+Cl2 2HCl,仔细观察题中所溶物质的体积,挖掘出潜在关系:H2的总物质的量等于O2的物质的量的两倍加上Cl2的物质的量。故 2HCl,仔细观察题中所溶物质的体积,挖掘出潜在关系:H2的总物质的量等于O2的物质的量的两倍加上Cl2的物质的量。故
V(H2)=2V(O2)+V(Cl2),分析选项,只有B才能恰好完全反应:9=2×4+1。
本题难度:简单
5、选择题 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是

A.图中A点溶液的pH=1
B.生成沉淀的最大质量为2.33g
C.原混合溶液中盐酸物质的量浓度为0.1mol/L
D.当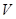 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO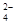 ═BaSO4↓ ═BaSO4↓
参考答案:A
本题解析:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+2H2O,发生的离子方程式是2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,D错;20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4?+? Ba(OH)2?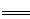 ?BaSO4↓? +? H2O ?BaSO4↓? +? H2O
1?1? 233g
x?0.02L×0.05mol·L-1? y
故x=0.02L×0.05mol·L-1=0.001mol,y=0.233g,
硫酸的物质的量浓度为 ?=0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错; ?=0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.06L×0.05mol·L-1=0.003mol,故n(HCl)=0.003mol×2-0.001mol×2=0.004mol,
故原溶液中HCl的物质的量浓度= ?=0.2mol·L-1,C错; ?=0.2mol·L-1,C错;
由图可知,A点硫酸完全反应,氢离子的浓度为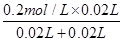 =0.1mol·L-1,则pH=-lg0.1=1,A对; =0.1mol·L-1,则pH=-lg0.1=1,A对;
综上所述,所以选A。
本题难度:简单
|