微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应式为:4Al+3O2+6H2O═4Al(OH)3下列说法不正确的是( )
A.电池工作时,电流由铝电极沿导线流向铂电极
B.正极反应式为:O2+2H2O+4e-═4OH-
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
参考答案:A.电池工作时,电流从正极铂电极沿导线流向负极铝电极,故A错误;
B.正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故B正确;
C.铂做成网状的目的是增大与氧气的接触面积,加快反应速率,故C正确;
D.Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故D正确,
故选A.
本题解析:
本题难度:简单
2、简答题 (1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
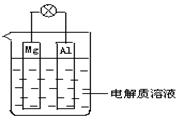
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___?;
②电解质溶液为NaOH溶液时,灯泡______(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应式为:_______________?;
Al电极上发生反应的电极反应式为:_______________?;
b.若灯泡不亮,其理由为:________________________?。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ ?+Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是?,若导线上转移电子1.5 mol,则溶解铜的质量是?。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液。其作用是:?。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:
??。
参考答案:(1)①2H+ + 2e- = H2↑;
②亮? a. 6H2O + 6e- = 6OH- + 3H2↑;2Al – 6e- + 8OH- =2AlO2- + 4H2O。
(2)Cu;48g;形成了Zn—Cu原电池,加快了化学反应的速率(注:必须强调形成Zn—Cu原电池,否则不得分);(3)H2 +2 OH- - 2e-=2H2O
本题解析:结合装置图,当电解质溶液为稀H2SO4时上述装置中灯泡亮,判断Al片作正极,Mg片作负极,此时Al电极上发生反应的电极反应式:①2H+ + 2e- = H2↑
②电解质溶液为NaOH溶液时,判断Al片作负极,Mg片作正极,灯光亮,Mg电极上发生的电极反应式为
a.?6H2O + 6e- = 6OH- + 3H2↑;Al电极上发生反应的电极反应式为:2Al – 6e- + 8OH- =2AlO2- + 4H2O。
(2)结合Cu+2Fe3+ =2Fe2+ ?+Cu2+,可判断电池的负极材料是Cu片,失去电子,发生氧化反应,Cu-2e- =Cu2+ 若导线上转移电子1.5 mol,则溶解铜的质量是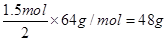 ,实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液的作用是Cu2++Zn=Zn2++Cu形成了Zn—Cu原电池,加快了化学反应的速率。
,实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液的作用是Cu2++Zn=Zn2++Cu形成了Zn—Cu原电池,加快了化学反应的速率。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为H2 +2 OH- - 2e-=2H2O
点评:原电池构造原理是高中化学的重点也是难点,燃料电池是新兴的题型,考生要注意掌握原电池原理,把握本质,正确书写电极反应方程式。
本题难度:一般
3、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中 _________ (填字母编号)。
_________ (填字母编号)。

(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。

①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)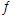 CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:

①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
参考答案:(18分)
(1)SO2+NH3+H2O===NH4++HSO3-(3分) BD(3分)
(2)①还原(2分)
②NO-2e-+O2-===NO2(2分)
(3)①< (2分) ②正向(2分)
③ 0.6 (2分) >(2分)
本题解析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH?)+c(HSO3?)+2c(SO32?),所以c(H+)—c(OH?)= +c(HSO3?)+2c(SO32?)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3?H2O)=c(HSO3?)+c(H2SO3)+c(SO32?),与电荷守恒式相减可得:c(H+)—c(OH?)=c(SO32?)+c(NH3?H2O)—c(H2SO3),故答案为BD。
(2)①根据O22?移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2?反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故?H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g)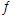 CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol?L?1) 1 2 0 0
转化浓度(mol?L?1) 0.8 0.8 0.8 0.8
平衡浓度(mol?L?1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)="1" < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
本题难度:困难
4、选择题 2009年8月15日,陕西省凤翔县政府新闻发布会宣布,东岭冶炼公司是导致凤翔县长青镇部分儿童血铅超标的主要原因。血铅超标,可致免疫力低下、学习困难、智商水平下降等症状。下列关于铅的说法正确的是? (? )
A.铅位于周期表中的第7周期、ⅣA
B.二氧化碳?二氧化铅均有很强的氧化性
C.与铅同主族的单质均能导电
D.在铅蓄电池中,负极电极方程式为:Pb + SO42--2e- =PbSO4
参考答案:D
本题解析:A:铅为第五周期第IVA族元素
B:二氧化碳的氧化性比较弱
C:金刚石不具有导电性
D:正确
本题难度:一般
5、填空题 锂电池一种是常用的电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起博器,一般使用时间可长达10年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是_______________。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因_____________。
最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。 ① 电池的正极反应式为___________________。
② 放电时固体电解质里的O2-离子的移动方向是向______极移动(填正或负)。
参考答案:锂的摩尔质量小;2Li+2H2O = 2LiOH+H2↑;O2+4e-=2O2-;负
本题解析:
本题难度:一般