CuSO4
参考答案:B
本题解析:略
本题难度:一般
2、选择题 有关电化学原理的推断正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程
B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH-
C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑
D.镀锌铁皮的镀层损坏后,铁更容易腐蚀
参考答案:C
本题解析:A.金属腐蚀是金属原子失去电子被氧化的过程,错误。B.钢铁吸氧腐蚀时,正反应式为:2H2O+O2+4e→4OH-,错误。C.阳极是失电子的反应,发生的反应为:2Cl-–2e→Cl2↑,正确。D.镀锌铁皮的镀层损坏后,形成原电池时锌做负极仍会对铁起到保护作用,错误。
本题难度:一般
3、选择题 下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
C.电解氯化铜溶液一定时间后,负极相连的石墨棒表面附着一层铜
D.把铁片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:B
本题解析:铁比铜活泼,形成原电池时,铁是负极,铜正极,A正确。氯化铜能把铜氧化,但还原产物是氯化亚铁,B不正确。电解池中和负极相连是阴极,所以铜离子在阴极放电,C正确。D中能形成原电池,铁作负极,加快反应速率。答案选B。
本题难度:一般
4、选择题 下列关于钢铁腐蚀与防护的说法正确的是
A.钢铁与电源的正极连接,钢铁可被保护
B.钢铁发生析氢腐蚀时,负极反应为:Fe-3e-=Fe3+
C.与铜质水龙头连接的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中能发生电化学腐蚀
参考答案:D
本题解析:A错,钢铁与电源的负极连接,钢铁可被保护,为外加电流的阴极保护法;
B错,钢铁发生析氢腐蚀时,负极反应为:Fe-2e-=Fe2+;C错,与铜质水龙头连接的钢质水管形成的原电池,钢铁易发生腐蚀;D正确,潮湿的空气中为中性或弱酸性,易发生吸氧腐蚀;
本题难度:一般
5、填空题 (12分).铅蓄电池是典型的可充型电池,电池总反应式为:
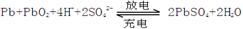
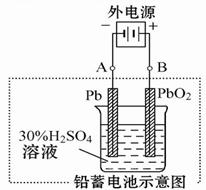
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________________ ;电解液中H2SO4的浓度将变 ______ ;当外电路通过1 mol电子时,理论上负极板的质量增加 _______? g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成 _____?___ ,电极反应:__________________ ,B电极反应_______________。
参考答案:(12分,每空2分)
(1)PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O?、小?、 48
(2)Pb? A极反应: PbSO4+2e- =" Pb" + SO42-?
B极反应: PbSO4+2H2O-2e- = PbO2+4H++ SO42-
本题解析:(1)原电池中正极得到电子,发生还原反应。所以根据放电时的方程式可知,正极的电极反应式是PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O。放电是消耗硫酸的,所以硫酸的浓度变小。负极失去电子,发生氧化反应,所以负极电极反应式是Pb-2e-+ SO42- = PbSO4,所以当外电路通过1 mol电子时,理论上负极板的质量增加96g/mol×0.5mol=48g。
(2)根据装置图可知,A电极和电源的负极相连,作阴极,得到电子,所以是二氧化铅得到电子生成单质铅,电极反应式是bSO4+2e- =" Pb" + SO42-。B电极和电源的正极相连,作阳极,硫酸铅失去电子,得到二氧化铅,电极反应式是PbSO4+2H2O-2e- = PbO2+4H++ SO42-。
点评:书写电极反应式的关键是准确判断出原电池的正负极、电解池的阴阳极等。而在电化学的有关计算时,往往常用电子得失守恒。
本题难度:一般
|