微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知2.16gX2O5中含有0.1mol氧原子,则X的相对原子质量为
A.28
B.28g/mol
C.14
D.14g/mol
参考答案:C
本题解析:分析:根据物质的构成可知物质的物质的量,再利用M=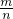 计算摩尔质量,摩尔质量与相对分子质量在数值上相等,以此来解答.
计算摩尔质量,摩尔质量与相对分子质量在数值上相等,以此来解答.
解答:2.16gX2O5中含有0.1mol氧原子,
则n(X2O5)=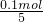 =0.02mol,
=0.02mol,
所以M(X2O5)=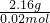 =108g/mol,
=108g/mol,
又摩尔质量与相对分子质量在数值上相等,
设X的相对原子质量为x,则
2x+16×5=108,
解得x=14,
故选C.
点评:本题考查物质的量及相对分子质量的计算,熟悉摩尔质量与相对分子之间的关系即可解答,较简单.
本题难度:简单
2、选择题 下列实验操作不能达到目的的是
A.除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸
B.制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性
C.检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡
D.使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液
参考答案:B
本题解析:A.向溶液加入MgCO3,发生沉淀溶解平衡:MgCO3(s) Mg2+(aq)+CO32-(aq)。这时Mg2+会与Fe3+发生双水解反应产生氢氧化铁沉淀和二氧化碳气体从而除去MgCl2酸性溶液中的Fe3+。不符合题意。B.制备硅酸胶体时应该加热蒸馏水至沸腾,然后向其中滴加饱和的硅酸钠水溶液,并继续加热,至溶液出现大量白色胶状物质。符合题意。C.Fe2-有还原性,容易被酸性高锰酸钾溶液氧化为Fe3+而使紫色褪去。因此可以用于检验其存在。不符合题意。D.氯化铵是强酸弱碱盐,水溶液显酸性。氢氧化镁沉淀能够在酸性环境中溶解。不符合题意。
Mg2+(aq)+CO32-(aq)。这时Mg2+会与Fe3+发生双水解反应产生氢氧化铁沉淀和二氧化碳气体从而除去MgCl2酸性溶液中的Fe3+。不符合题意。B.制备硅酸胶体时应该加热蒸馏水至沸腾,然后向其中滴加饱和的硅酸钠水溶液,并继续加热,至溶液出现大量白色胶状物质。符合题意。C.Fe2-有还原性,容易被酸性高锰酸钾溶液氧化为Fe3+而使紫色褪去。因此可以用于检验其存在。不符合题意。D.氯化铵是强酸弱碱盐,水溶液显酸性。氢氧化镁沉淀能够在酸性环境中溶解。不符合题意。
本题难度:一般
3、选择题 除去下列物质中少量杂质的方法正确的是(?)
A.除去FeCl2溶液中混有的FeCl3加入过量铁粉,过滤
B.除去NO2中混有的NO:用水洗气
C.除去SO2中混有的HCl:用饱和亚硫酸钠溶液洗气
D.除去Cu粉中混有的Cu0:加适量稀硝酸后,过滤、洗涤
参考答案:A.
本题解析:
试题解析:B错误,NO2与水反应。C.除去SO2中混有的HCl可用饱和亚硫酸氢钠溶液洗气。D,Cu与稀硝酸反应。
本题难度:一般
4、选择题 在标准状态下,1体积的水溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,则此氨水的浓度是
A.18.4 mol/l
B.20.4 mol/l
C.30.7%
D.38.5%
参考答案:A
本题解析:
本题难度:困难
5、选择题 除去括号内杂质所用试剂和方法都正确的是( )
A.NaCl(Na2CO3)----加稀盐酸,分液
B.SO2(HCl)----氢氧化钠溶液,洗气
C.NaCl溶液(碘)----四氯化碳,萃取、分液
D.KNO3溶液(KCl)----降温结晶,蒸馏
参考答案:A.分液分离能分层的物质,稀盐酸和NaCl不分层,故A错误;
B.氢氧化钠能与二氧化硫和HCl反应,加工原物质除掉,故B错误;
C.碘易溶于四氯化碳,不溶于水,可做萃取剂,故C正确;
D.KNO3和KCl的溶解度随温度变化不同,可用结晶法分离,故D正确.
故选CD.
本题解析:
本题难度:一般