| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《实验方案的设计与评价》高频考点巩固(2017年模拟版)(二)
 参考答案:B 本题解析: 本题难度:简单 2、简答题 市场销售的某种食用精制盐包装袋上有如下说明(部分):
______KIO3+______KI+______H2SO=______K2SO4+______I2+______H2O (2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳. ①Na2SO3稀溶液与I2反应的离子方程式是______ ②某学生设计回收四氯化碳的操作步骤为: a、将碘的四氯化碳溶液置于分液漏斗中; b、加入适量Na2SO3稀溶液; c、分离出下层液体. 以上设计中遗漏的操作及在上述操作中的位置是______ (3)已知:I2+2S2O32-=2I-+S4O62- 某学生测定食用精制盐的碘含量,其步骤为: a、准确称取12.7g食盐,加适量蒸馏水使其完全溶解; b、用稀硫酸酸化所得溶液,加入足量KI溶液,使食用盐中KIO3与KI反应完全; c、以淀粉溶液为指示剂,逐滴加入物质的量浓度为6.0×10-4mol/L的Na2S2O3溶液20.0mL,恰好反应完全. ①判断c中反应恰好完全依据的现象是______ ②根据以上实验和包装说明,所测精盐的碘含量是______mg/kg. 参考答案:(1):该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,所以反应方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O, 本题解析: 本题难度:一般 3、选择题 下列有关实验的说法错误的是 参考答案:C 本题解析: 本题难度:一般 4、简答题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
实验小组设计如下实验方案: 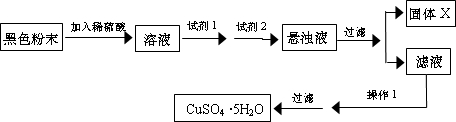 试回答: ①试剂I为______,试剂II为______(填字母). ②固体X的化学式为______. ③操作I为______. 参考答案:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液呈红色.故答案为:溶液变为血红色; 本题解析: 本题难度:一般 5、选择题 从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是 参考答案:D 本题解析: 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《阿伏伽德罗.. | |