微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
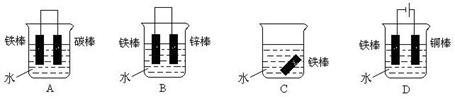
(1)下列哪个装置可防止铁棒被腐蚀_____________ 。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如右: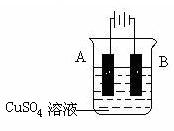
请回答:
①A电极对应的金属是______(写元素名称),B电极的电极反应式是?。
②若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为51.2 g,则电镀时电路中通过的电子物质的量为_______。
参考答案:(1)BD(2分)?(2)①铜(2分)? Cu2+ +2e- ="Cu" (3分)
②0.8 mol(3分)(单位未没写扣1分)
本题解析:略
本题难度:简单
2、填空题 (1)[2013·四川理综,11(4)]以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是______________________________。
(2)[2013·重庆理综,11(2)]化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
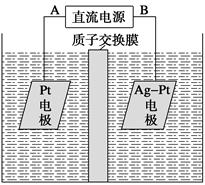
①电源正极为__________(填A或B),阴极反应式为__________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)[2013·新课Ⅱ,36(1)]锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图所示。
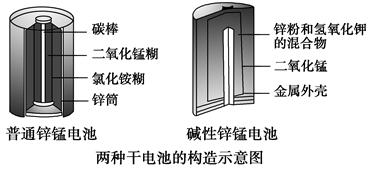
回答下列问题:
普通锌锰电池放电时发生的主要反应为
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是_____________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是________________。
参考答案:(1)Al+3NiO(OH)+NaOH+H2O===NaAlO2+3Ni(OH)2
(2)①A 2NO3—+6H2O+10e-===N2↑+12OH-
②14.4
(3)①Zn NH4Cl MnO2+NH4++e-===MnOOH+NH3 ②碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答对一条即可,其他合理答案也可)
本题解析:(1)该新型电池放电时,关键判断Al的氧化产物。由于NaOH溶液的存在,Al被氧化生成NaAlO2而不是Al(OH)3,故电池反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O===NaAlO2+3Ni(OH)2。
(2)阴极:2NO3—+6H2O+10e-===N2↑+12OH-
阳极:10OH--10e-===5H2O+5/2O2↑
在阳极区生成的H+通过质子交换膜到达阴极区,所以,当电子过程中转移10 mol e-时,
Δm左=5/2mol×32 g·mol-1+10 g=90 g
Δm右=28 g-10 g=18 g
所以当转移2 mol e-时,膜两侧电解液的质量变化差为(90-18)/5=14.4 g。
(3)①该电池中,负极材料是较活泼的金属Zn,电解质的主要成分是NH4Cl,正极发生还原反应,电极反应为:MnO2+NH4++e-===MnOOH+NH3。②与普通锌锰电池相比,碱性锌锰电池不易发生电解质的泄漏,因为消耗的负极改装在电池内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
本题难度:简单
3、填空题 对金属制品进行抗腐蚀处理,可延长其使用寿命.
(1)以下为铝材表面处理的一种方法

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________.
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________.取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_____________________________.
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________.
(3)利用下图装置,可以模拟铁的电化学防护.
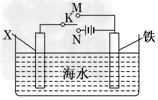
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处.若X为锌,开关K置于M处,该电化学防护法称为________.
参考答案:(1)①2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑(或:2Al+2OH-+2H2O===2AlO2-+3H2↑);b;②2Al+3H2O===Al2O3+6H++6e-;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀
(2)补充溶液中消耗的Cu2+,保持溶液中Cu2+
(3)N;牺牲阳极的阴极 保护法(或:牺牲阳极保护法)
保护法(或:牺牲阳极保护法)
本题解析:
本题难度:一般
4、选择题 水中的某些重金属污染物又可以被微生物转化为新的重金属化合物,使水的污染程度加重.例如,水中的氯化汞会发生下列变化:HgCl2+CH4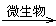 CH3HgCl+HCl.下列说法中不正确的是( )
CH3HgCl+HCl.下列说法中不正确的是( )
A.HgCl2转化为CH3HgCl的反应属于取代反应
B.在沼气池的水中HgCl2更容易转化为CH3HgCl
C.误服含HgCl2的废水可使蛋白质发生盐析
D.HgCl2比CH3HgCl毒性小
参考答案:C
本题解析:
本题难度:简单
5、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H+ + 2e—=H2↑
B.Fe2+ + 2e—=Fe
C.2H2O + O2 + 4e—=4OH—
D.Fe3+ + e—=Fe2+
参考答案:C
本题解析:钢铁发生吸氧腐蚀时,氧气在正极得到电子,铁在负极失去电子,所以答案选C。
点评:钢铁是高考中的常见考点和题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学习效率。
本题难度:简单