微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
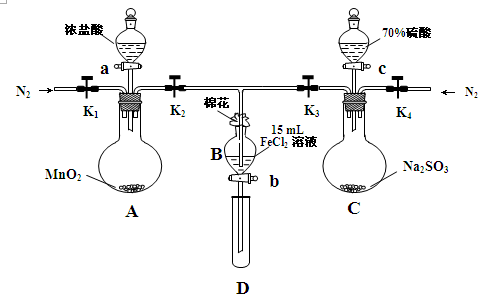
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子
| 过程Ⅵ B溶液中 91EXAm.org含有的离子
|
甲
| 有Fe3+无Fe2+
| 有SO42-
|
乙
| 既有Fe3+又有Fe2+
| 有SO42-
|
丙
| 有Fe3+无Fe2+
| 有Fe2+
|
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液
颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
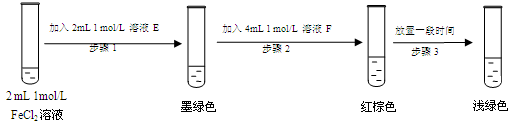
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
参考答案:(1)排除空气(1分) (2)NaOH溶液 (3)MnO2 + 4HCl(浓) △MnCl2+Cl2↑+ 2H2O
(4)70%H2SO4中c(H+)大 (5)2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42-+4H+ (6)乙、丙
(7)① Na2SO3溶液 、FeCl3溶液
②Fe3+ 消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq) FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。(3分)
FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。(3分)
本题解析:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气。
(2)氯气、二氧化硫有毒,棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气。
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为MnO2 + 4HCl(浓) △MnCl2+Cl2↑+ 2H2O。
(4)因氢离子浓度越大,反应速率越快,则70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大,所以反应速率快。
(5)铁离子能把二氧化硫氧化生成硫酸,反应的离子方程式为2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42-+4H+。
(6)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,故答案为:乙、丙。
(7)①E与氯化亚铁溶液反应产生墨绿色,说明反应中有亚硫酸亚铁生成,因此E应该是Na2SO3溶液。根据FeSO3(墨绿色)与FeCl3(黄色)的混合后溶液显红棕色可知,F应该是FeCl3溶液。
②铁离子具有氧化性,因此Fe3+ 消耗 SO32-,导致c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq) FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
考点:考查性质实验方案的设计及氧化还原反应和平衡移动原理应用
本题难度:困难
2、选择题 将200 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为
A.0.3 mol/L
B.0.2 mol/L
C.0.05 mol/L
D.0.04 mol/L
参考答案:B
本题解析:考查物质的量浓度的计算。稀释过程中溶质是不变的,所以根据c=n/V可知,稀释后NaOH的物质的量浓度为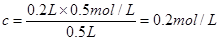 ,答案选B。
,答案选B。
本题难度:困难
3、选择题 A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为
A.A>B>C?
B.A>C>B?
C.B>A>C?
D.B>C>A
参考答案:C
本题解析:考查金属性强弱比较。比较元素金属性强弱的依据1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。5.依据金属活动性顺序表(极少数例外)。6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。 7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。8.依据电解池中阳离子的放电(得电子,氧化性)顺序。优先放电的阳离子,其元素的金属性弱。所以答案选C。
本题难度:简单
4、选择题 在用Zn、Cu片和CuSO4溶液组成的原电池装置中,经过一段时间工作后,下列说法中正确的是
A.锌片是正极,铜片质量不变
B.电流方向是从锌片流向铜片
C.锌片是负极,铜片质量不变
D.锌片是负极,铜片质量增加
参考答案:D
本题解析:用Zn、Cu片和CuSO4溶液组成的原电池,锌比铜活泼,锌做负极,失电子,锌片质量减小,铜做正极,溶液中的铜离子得电子在正极山析出,质量增加,故选D。
本题难度:困难
5、选择题 2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他提示了真核生物体内细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法正确的是
A.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
B.可以采用多次盐析或多次渗析的方法分离提纯蛋白质
C.蛋白质均为天然有机高分子化合物,没有蛋白质就没有生命
D.人造丝和蚕丝的成分都是蛋白质,灼烧时均产生烧焦羽毛的气味
参考答案:B
本题解析:硫酸铵使蛋白质盐析,而不是变性。可以人工合成蛋白质,C不正确。人造丝不是蛋白质,主要成份是纤维素。所以正确的答案是B。
本题难度:一般