微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是?
[? ]
A.强氧化性?
B.吸水性?
C.酸性?
D.脱水性
参考答案:C
本题解析:
本题难度:简单
2、简答题 某老师取6.4g铜丝和12mL18mol/L浓硫酸按教材中“铜与浓硫酸反应”的实验装置进行实验.
(1)试管A中反应的方程式是______.
(2)试管B用来探究SO2的漂白性,则应装的试剂是______.
(3)试管C中的实验现象为______.
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g.则试管中余酸的物质的量浓度约为______(假设溶液体积不变).

参考答案:(1)铜和浓硫酸加热反应,浓硫酸具有强氧化性氧化铜为硫酸铜,本身被还原为二氧化硫,依据化学方程式的书写原则写出化学方程式:Cu+2H2SO4(浓)??△?.?CuSO4+SO2↑+2H2O;
?故答案为:Cu+2H2SO4(浓)??△?.?CuSO4+SO2↑+2H2O;?
(2)探究SO2的漂白性需要用品红,二氧化硫通入品红会褪色;
故答案为:品红;
(3)二氧化硫通入氯水中发生反应Cl2+SO2+2H2O=H2SO4+2HCl,所以氯水中氯气的淡黄绿色逐渐褪去;
故答案为:淡黄绿色逐渐褪去;
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g,说明反应了铜的质量为6.4g-3.2g=3.2g,物质的量为0.05mol,发生反应的化学方程式为:
Cu+2H2SO4(浓)??△?.?CuSO4+SO2↑+2H2O?消耗硫酸物质的量为0.1mol,所以剩余硫酸物质的量为0.216mol-0.1mol=0.116mol,剩余硫酸浓度=0.116mol0.012L=9.7mol/L;
故答案为:9.7mol/L;
本题解析:
本题难度:一般
3、简答题 某合金中铜和铁的物质的量均为0.3mol,将其全部投入b?mL?4mol?L-1的硝酸溶液中,使其充分反应(假设N0是唯一的还原产物).
(1)若金属有剩余,其质量为m1g,在溶液中再滴入稀硫酸后,剩余金属为m2g,则m1与m2的关系为:m1______(填“>”、“<”或“=”)m2.
(2)若b=450mL,则溶液中的阳离子为______.
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程).
参考答案:(1)反应后溶液中存在大量的NO3-,在酸性条件下具有强氧化性,可继续与金属反应,所以加入硫酸后,NO3-与金属继续发生氧化还原反应而溶解金属,所以金属的质量减小,
故答案为:>;
(2)n(HNO3)=0.45L×4mol/L=1.8mol,
可能反应有①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
③Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
铜完全反应消耗硝酸0.8?mol,
如发生反应②,0.3?mol?Fe需要硝酸0.8?mol,
如发生反应③,0.3?mol?Fe需要硝酸1.2mol,
而此时:0.8mol<(1.8mol-0.8mol)<1.2mol,
所以溶液中存在的离子有Fe3+、Fe2+、Cu2+,
故答案为:Fe3+、Fe2+、Cu2+;
(3)有关反应为:①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
③Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
根据方程式①计算,0.3mol?Cu需要硝酸0.8?mol,
如果硝酸不足按方程式②计算,0.3mol?Fe需要硝酸0.8?mol,
共需硝酸1.6mol,则b=400mL,
如果硝酸充足则按方程式③计算,0.3molFe需要硝酸1.2mol,
共需硝酸2mol,则b=500mL,
所以400mL≤b≤500mL,
答:b的取值范围为400mL≤b≤500mL.
本题解析:
本题难度:一般
4、选择题 下列物质中: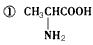
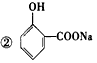
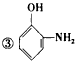 ④NaHCO3 ⑤Al(OH)3,既可以与盐酸反应,又可以与NaOH溶液发生反应的是
④NaHCO3 ⑤Al(OH)3,既可以与盐酸反应,又可以与NaOH溶液发生反应的是
[? ]
A.①④⑤
B.①②④⑤
C.②③⑤
D.①②③④⑤
参考答案:D
本题解析:
本题难度:简单
5、填空题 25℃时,若体积为Va、PH=a的某一元强酸与体积为Vb、PH=b的某一元强碱混合,恰好中和,且已知
Va<Vb和a=0.5b。请填写下列空白
(1)a值可否等于3(填“可”或“否”)______,其理由是________________________。
(2)a值可否等于5(填“可”或“否”)______,其理由是________________________。
(3)a的取值范围是__________________。
参考答案:(1)否;b=6,溶液显酸性
(2)否;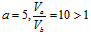 不可能
不可能
(3)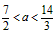
本题解析:
本题难度:一般