微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.增大压强,活化分子百分数增大,反应速率一定增大
B.升高温度,反应物分子总数增加,活化分子百分数不变,反应速率一定增大
C.加入反应物,使活化分子百分数增大,反应速率增大
D.使用催化剂可降低反应的活化能,增大活化分子百分数,增大反应速率
参考答案:D
本题解析:
本题主要考查:用有效碰撞理论解释化学反应速率改变的微观因素。学生解决问题时要理清:活化分子个数,活化分子百分数,活化能等概念。
A:错在没有理解压强作用的前提条件是对于有气体物质的化学反应。
B:错在没有理解:升高温度是提高了反应物分子的能量,活化能不变,活化分子个数增加,活化分子百分数相应增大。
C:错在没有理解:其它条件不变时,加入反应物,反应物分子总个数和活化分子个数按相同倍数增加,活化分子百分个数不变。
D:正确。
本题难度:简单
2、实验题 某化学反应2A(g)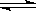 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为?mol/(L·min)。
(2)在实验2,A的初始浓度C2=?mol/L。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3?V1(填>、=、<)且C3?1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是?反应(选填吸热、放热)。
参考答案:(1)0.013? (2)1? (3)﹥﹥(4)吸热
本题解析:(1)υ=(0.80-0.67)/10="0.013" mol·L—1·min—1
(2)实验2与1在相同的温度下达到平衡时的各物质浓度相同,则其初始浓度也相同。
(3)同样是在10至20分钟时间内,实验3的△n=0.17mol,可证明实验3反应速率快;而在0至10分钟时间内的△n>0.17mol,所以C3>1.0mol/L
(4)升高温度平衡后,A的量减小,说明平衡右移,正反应是吸热反应。
本题难度:一般
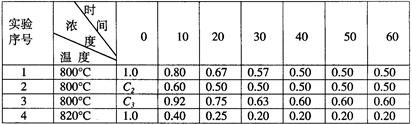
3、实验题 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH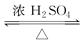 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
同一反应时间
| ?
| 同一反应温度
|
反应温度/℃
| 转化率(%)
| 选择性(%)*
| ?
| 反应时间/h
| 转化率(%)
| 选择性(%)*
|
40
| 77.8
| 100
| ?
| 2
| 80.2
| 100
|
60
| 92.3
| 100
| ?
| 3
| 87.8
| 100
|
80
| 92.6
| 100
| ?
| 4
| 92.3
| 100
|
120
| 94.5
| 98.7
| ?
| 6
| 93.0
| 100
|
?
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h? B.80 ℃,2 h
C.60 ℃,4 h? D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
参考答案:(1)增大乙醇的浓度 加热及时蒸出产物
(2)温度过高,发生了副反应 冷凝效果不好,部分产物挥发了
(3)产生大量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难(任填两种) (4)①C ②发生了副反应
本题解析:(1)酯化反应是一个可逆反应,欲提高乙酸的转化率,可以增大乙醇的浓度或加热及时蒸出产物等。
(2)因乙酸、乙醇都易挥发,而图中装置竖直导管太短,冷凝效果不好,原料来不及反应就被蒸出,温度过高发生副反应,这些因素都会导致产率偏低。
(3)浓H2SO4除具有催化作用外,还具有强氧化性和脱水性,因此可能造成产生大量的酸性废液、造成环境污染、部分原料炭化等。
(4)①从表中可以看出,同一反应时间60 ℃时的转化率远大于40 ℃而接近80 ℃,所以60 ℃时最合适,而以同一反应温度下的不同时间来看,4小时转化率已较高,接近6小时的转化率,故选C。
②当反应温度达120 ℃时反应选择性降低,则说明发生了副反应。
本题难度:一般
4、选择题 下列措施对增大反应速率明显有效的是
[? ]
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
参考答案:D
本题解析:
本题难度:一般
5、选择题 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是?
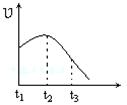
A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的主要原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的主要原因是随着反应的进行镁体积 91ExAM.org减少
D.从t2→t3的主要原因是随着反应的进行温度越来越低
参考答案:A
本题解析:应用镁和盐酸的反应是放热反应,随着温度的升高,反应速率逐渐增大,A正确。但随着反应的进行,氢离子的浓度逐渐减小,所以反应速率又逐渐降低下来,因此BCD都是错误的,答案选A。
本题难度:一般