|
高考化学试题《影响化学反应速率的因素》高频考点特训(2017年练习版)(四)
2017-07-18 01:52:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 23.在反应C(s)+CO2(g)=2CO(g)中,能使反应速率加快的是
①增大压强 ②升高温度 ③将C粉碎
④通CO2气体 ⑤加入足量木炭粉
A.①②③④
B.①②③
C.①②④
D.全部
|
参考答案:A
本题解析:增大压强、升高温度、增大接触面积、增大反应物的量均可使反应速率加快,由于碳为固体,增大碳粉的用量对反应速率没有影响。
考点:反应速率的影响因素
点评:认真分析反应速率的影响因素。
本题难度:一般
2、实验题 (15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。
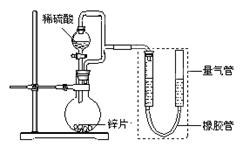
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是?。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
序号
| V(H2SO4)/mL
| c(H2SO4)/mol·L-1
| t/s
| Ⅰ
| 40
| 1
| t1
| Ⅱ
| 40
| 4
| t2
|
?
比较实验Ⅰ和Ⅱ可以得出的实验结论是?。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号)?。
a.石墨? b.银? c.铜? d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度。
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为?。
②本实验在读数前对量气管的操作是?。
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将?。(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号)?。
a.NH4Cl溶液? b.C2H5OH? c.Na2CO3溶液? d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是?。
参考答案:(15分)(1)①Zn+2H+ =Zn2++H2↑(1分)
②在其它条件一定时,化学反应速率随反应物浓度的增大而增大(2分)③abc(2分)
(2)①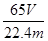 ×100%(2分) ×100%(2分)
②待气体冷却后,调整右边量气管高度,使其左右管中水面相平(2分) ③无影响(2分)
(3)①c?(2分)?②量气管左管的水面上升,右管的水面下降(2分)
本题解析:(1)①锌和稀硫酸反应的离子方程式为Zn+2H+ =Zn2++H2↑。
②根据表中数据可知,实验Ⅰ和Ⅱ相比,实验Ⅱ中硫酸的浓度大,用时少,这说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大。
③所测得的反应速率均大于上述实验对应的数据,这说明粗锌片中所含杂质与锌构成了原电池,且杂质的金属性弱于锌的,所以符合条件的是石墨、银和铜,答案选abc。
(2)①氢气的体积在标准状况下是VL,则氢气的物质的量是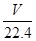 mol,则根据方程式可知,参加反应的锌的物质的量是 mol,则根据方程式可知,参加反应的锌的物质的量是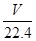 mol,其质量是 mol,其质量是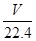 mol×65g/mol= mol×65g/mol=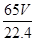 g,所以粗锌片的纯度为 g,所以粗锌片的纯度为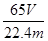 ×100%。 ×100%。
②由于气体的体积受温度和压强影响大,所以在读数前对量气管的操作是待气体冷却后,调整右边量气管高度,使其左右管中水面相平。
③由于装置是封闭的,所以稀硫酸的体积并不能影响进入量气管的氢气体积,因此对实验结果无影响。
(3)①要用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀,则电解质溶液的酸性应该很弱,甚至显中性或碱性。氯化铵溶于水显酸性,稀硫酸溶于水显酸性,乙醇是非电解质,碳酸钠溶液显碱性,所以答案选c。
②如果发生吸氧腐蚀,则装置中压强降低,所以能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管左管的水面上升,右管的水面下降。
本题难度:一般
3、选择题 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
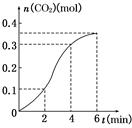
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后又减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1
参考答案:A
本题解析:首先要看明白图像,图中的曲线表明,二氧化碳的产生速率先快后慢。在第一个2 min内产生了0.1 mol CO2,第二个2 min内产生了0.2 mol CO2,第三个2 min内产生了0.05 mol CO2,反应速率先增大后减小;先增大是由于反应放热,使溶液温度升高,导致反应速率增大,4 min后速率下降则是由于浓度降低所引起的,通过计算知,A项错误,应该是2 min~4 min的平均速率最大。
本题难度:一般
4、填空题 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。

当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是__________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是___________________________。
参考答案:(1)BD
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ/mol
(3)H2O2分解速率加快
(4)2Cu2++SO32-+2Cl-+H2O2 CuCl↓+SO42-+2H+ CuCl↓+SO42-+2H+
本题解析:
本题难度:一般
5、选择题 在673K、30MPa下,在密闭容器中进行合成氨反应: N2(g)+3H2(g) 2NH3(g)?△H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是 2NH3(g)?△H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
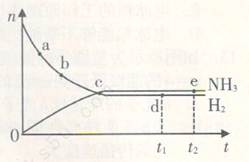
A.正反应速率:a点小于b点
B.c点处反应达到平衡
C.d点和e点处的n(N2)不一样
D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大
参考答案:D
本题解析:在N2(g)+3H2(g) 2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项。A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A错误;B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;故选D。 2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项。A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A错误;B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;故选D。
本题难度:一般
|