微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某课外活动小组做了如下关于钾的探究实验.
(1)钾与水反应
实验中钾常会着火燃烧,并发生轻微爆炸,由此现象可以得出的结论是______(任写一个),该反应的离子方程式是______.
(2)钾与氯气反应
该实验中可选用如下方案制备氯气,其中最合理的是______(填序号).
| 方案序号 | 所用试剂 | 净化剂 | 干燥剂
A
MnO2、稀盐酸
饱和食盐水
浓硫酸
B
Ca(ClO)2、浓盐酸
饱和食盐水
无水硫酸铜
C
氯酸钾、浓盐酸
饱和碳酸钠溶液
浓硫酸
D
KMnO4、浓盐酸
水
碱石灰
|
你所选取的最合理的方案中一定会用到的仪器是______(填序号).
A.长颈漏斗?B.圆底烧瓶
C.酒精灯?D.洗气瓶
(3)钾与氧气反应的实验
经查找资料知:钾与氧气反应可能生成K2O、K2O2、KO2.
①取一定量的钾在空气中点燃,使其充分反应;
②将生成物研成细粉备用;
③常温下,利用如图所示装置探究生成物成分及含量.
据此回答下列问题:
①使细粉末与水反应的操作是______.
②测量气体体积时应注意的事项是______.
③若钾与氧气燃烧的产物为K2O2、KO2,取燃烧产物3.94g进行上述实验,测得气体的体积为868.0mL,则KO2的质量分数约为______.
(已知:常温下,气体的摩尔体积为24.8L/mo1)
参考答案:(1)钾和水发生反应常会着火燃烧,并发生轻微爆炸,说明反应是放热反应,反应的离子方程式为:2K++2H2O=2K++2OH-+H2↑;
故答案为:钾与水反应放热,2K++2H2O=2K++2OH-+H2↑;
(2)A、MnO2、稀盐酸不能反应生成氯气,故A错误;
B、Ca(ClO)2具有强氧化性能氧化浓盐酸生成氯气,通过饱和食盐水除去氯化氢,通过无水硫酸铜吸收水蒸气,故B正确;
C、氯酸钾、浓盐酸反应生成氯气,通入饱和碳酸钠溶液吸收氯化氢反应生成二氧化碳,也吸收氯气反应,故C错误;
D、KMnO4具有强氧化性氧化浓盐酸生成氯气,水除去氯化氢,同时吸收氯气,碱石灰会吸收氯气,故D错误;
故选B.
制备氯气后的净化装置需要用洗气瓶进行,加入液体用分液漏斗,反应容器可以是试管、烧瓶等,反应有的需要加热反应,有的常温反应,故选D.
(3)①使细粉末与水反应的操作,将仪器A向左倾斜,使水与样品充分接触发生反应;
故答案为:将仪器A向左倾斜,使水与样品充分接触;
②依据实验装置,测量气体体积时应注意的事项是,将气体冷却到室温,移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压相等,平视读数;
故答案为:将气体冷却到室温,移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压相等,平视读数;
③设样品中K2O2为 xmol,KO2物质的量为ymol,依据化学方程式2K2O2+2H2O=4NaOH+O↑;4KO2+2H2O=4KOH+3O2↑;
得到110x+71y=3.94
x2+3y4=0.86824.8
解得:x=0.01,y=0.04,
所以KO2的质量分数=0.04×713.94×100%=72.08%
故答案为:72.08%
本题解析:
本题难度:一般
2、选择题 在实验室进行物质制备,下列设计中,理论上正确、操作上可行、经济上合理、环境上友好的是( )
A.C
COCO2Na2CO3
B.CuCu(NO3)2溶液Cu(OH)2
C.FeFe2O3Fe2(SO4)3溶液
D.CaOCa(OH)2溶液溶液
参考答案:A、碳不完全燃烧可生成一氧化碳,一氧化碳高温下与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;理论上正确,反应过程中产生、利用污染环境的物质CO,不符合绿色化学,一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸,操作上较为复杂,故A错误;
B、铜与硝酸银反应可生成硝酸铜,硝酸铜与氢氧化钠可生成氢氧化铜沉淀;理论上正确,操作上也较简便,银比铜要贵重,利用硝酸银、氢氧化钠制取氢氧化铜,经济上不合理,故B错误;
C、铁在氧气中燃烧生成四氧化三铁而不能生成三氧化二铁,因此该方案在理论上就是错误的,故C错误;
D、氧化钙与水反应可生成氢氧化钙,氢氧化钙与碳酸钠反应可生成氢氧化钠;理论上正确,操作也只需要加入液体较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,符合绿色化学,故D正确;
故选:D.
本题解析:
本题难度:简单
3、实验题 某课外小组同学对不同条件下铁钉的锈蚀进行了实验,并于一周后观察。

(1)铁钉被腐蚀程度最大的是____(填实验序号)。
(2)实验③中主要发生的是____(填“化学腐蚀”或“电化学腐蚀”)。
(3)根据上述实验,你认为铁发生电化学腐蚀的条件是____。 实验④中正极的电极反应式为________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防止金属被腐蚀可 采取的措施是____(至少写两种)。
参考答案:(1)④
(2)电化学腐蚀
(3)铁与电解质溶液接触、与潮湿空气接触; O2+2H2O+4e-==4OH-
(4)定期涂防锈漆;改变金属内部结构制成不锈钢、其他合金;保持环境的干燥等
本题解析:
本题难度:一般
4、简答题 MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料.实验室模拟以MnO2为原料生产MnCO3的工艺流程如图1: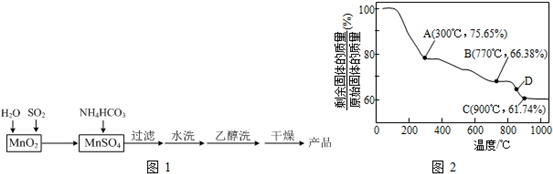
已知:MnCO3难溶于水和乙醇,受热易分解.
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、______.
(2)①检验水洗是否合格的方法是______.②水洗结束后,用乙醇洗涤的目的是______.
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图2所示.则300℃时,剩余固体中n(Mn):n(O)为______;图中点D对应固体的成分为______(填化学式).
参考答案:(1)过滤操作需要漏斗,玻璃棒,烧杯;
故答案为:玻璃棒;
(2)①分析流程可知,碳酸氢铵和硫酸锰反应生成碳酸锰沉淀,洗涤目的是洗去沉淀表面的硫酸根离子和铵根离子,设计方案为:取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
故答案为:取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
②水洗后,用乙醇洗涤,依据乙醇的性质分析,乙醇是易挥发的液体,操作中便于沉淀低温干燥,防止碳酸锰受热分解
故答案为:乙醇易挥发,便于低温干燥,防止MnCO3受热分解;
(3)设MnCO3的物质的量为1mol,即质量为115g
①A点剩余固体质量为115g×75.65%=87g
减少的质量为115g-87g=28g
可知MnCO3失去的组成为CO
故剩余固体的成分为MnO2
剩余固体中n(Mn):n(O)=1:2;
故答案为:1:2;
②C点剩余固体质量为115g×61.74%=71g
据锰元素守恒知m(Mn)=55g,则m(O)1=71g-55g=16g
则n(Mn):n(O)=5555:1616=1:1
故剩余固体的成分为MnO
同理,B点剩余固体质量为115g×66.38%=76.337g
因m(Mn)=55g,则m(O)2=76.337g-55g=21.337g
则n(Mn):n(O)=5555:21.33716=3:4
故剩余固体的成分为Mn3O4
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物;
故答案为:Mn3O4与MnO;
本题解析:
本题难度:一般
5、实验题 在常温下,Fe与水并不起反应,但在高温下,红热的铁能与水蒸气反应,有氢气生成,现用下图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题
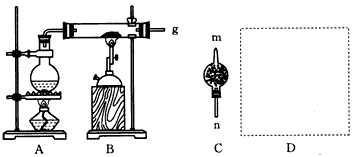
(1)写出铁在高温下与水蒸气反应的化学方程式:________________________。
(2)干燥管C内盛放的药品是____或____。干燥管的____(填“m”或“n”)端与g导管相连接。
(3)在D处画出用简单方法(用试管)来收集氢气的装置图(所需其他仪器自己选择)。
(4)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_________________。
(5)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)CaCl2;碱石灰(或CaO,答案合理均可);n? (3) (4)为硬质玻璃管内Fe与水蒸气的反应提供持续不断的水蒸气
(4)为硬质玻璃管内Fe与水蒸气的反应提供持续不断的水蒸气
(5)将收集到的气体验纯后点燃,火焰呈淡蓝色,在火焰上方罩一干冷烧杯,烧杯内壁有小液滴出现,证明收集到的气体是氢气
本题解析:
本题难度:一般