微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于电负性的叙述中不正确的是
[? ]
A.电负性用来描述不同元素的原子对键合电子吸引力的大小
B.电负性是以氟为4.0、锂为1.0作为标准的相对值
C.元素电负性越小,元素非金属性越强
D.元素电负性越大,元素非金属性越强
2、简答题 [化学-物质结构与性质]
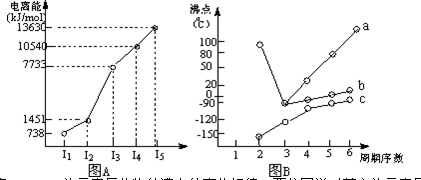
Ⅰ.短周期某主族元素M的电离能如图(A)所示.则M元素位于周期表的第______族.
Ⅱ.图B折线c可以表达出第______族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:______(填“a”或“b”)
Ⅲ.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)写出这三种元素电负性由大到小的顺序______(填元素符号)
(2)砷原子核外电子排布式为______
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为______,该化学?键能够形成的原因是______.
3、选择题 下列物质中属于电解质的是
A.铁
B.熔融的氯化钠
C.稀硫酸
D.蔗糖固体
4、填空题 不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方。下表是某些短周期元素的电负性值
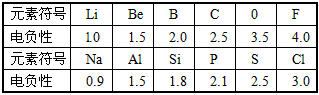
(1)通过分析电负性变化规律,确定N、Mg最接近的电负性 范围:___<Mg<___;____<N<______
(2)推测电负性与原子半径的关系是____________。上表中短周期元素电负性的变化特点,体现了元素性质的__________变化规律。
(3)某有机化合物的结构式为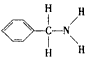 ,其中C-N键中,你认为共用电子对偏向于__________(写原子名称)一方。
,其中C-N键中,你认为共用电子对偏向于__________(写原子名称)一方。
(4)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键;小于1.7时,一般为共价键。试推断,AlBr3中化学键类型是___________。
5、选择题 下列物质的水溶液能导电,但属于非电解质的是
A.CH3CH2COOH
B.Cl2
C.NH4HCO3
D.SO2