微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列判断正确的是?(? )
)
A.非金属氧化物一定是酸酐
B.酸酐一定是非金属氧化物
C.晶体中一定存在化学键
D.碱性氧化物一定是金属氧化物
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列各组中,含的离子晶体、分子晶体、原子晶体各一种的是(?)
A. ?B. 金刚石、
?B. 金刚石、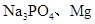
C. HF、SiC、Ar?D. 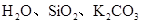
参考答案:D
本题解析:A.KCl是离子晶体,而H2SO4、S单质都是分子晶体。错误。B. 金刚石是原子晶体;Na3PO4是离子晶体,Mg是金属晶体。错误。C. HF、Ar都是分子晶体,而 SiC是原子晶体。错误。D. H2O是分子晶体;SiO2是原子晶体;K2CO3是离子晶体.符合题意。正确。
本题难度:一般
3、填空题 图(1)是NaCl的晶体结构。在NaCl的晶体结构中,钠离子和氯离子可以被看成是不等径的刚性网球,并彼此相切如图(2)。离子键的键长是相邻阴、阳离子的半径之和如图(3),已知a为常数。
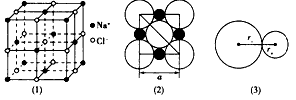
试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引_______个Cl-,Na+数目与C1-数目之比为_____。
(2)Na+半径与Cl-半径之比为r+:r-=_______(已知 = 1.414,=1.732,=2.236)。
(3)NaCI晶体不存在分子,但在温度达到l 413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6 L (已折算为标准状况),则此时氯化钠气体的分子式为________。
参考答案:(1)6;1:1
(2)0.414:1
(3)Na2Cl2
本题解析:
本题难度:一般
4、选择题 下列有关物质的熔沸点说法错误的是
A.Li>Na>K>Rb
B.F2<Cl2<Br2<I2
C.金刚石>晶体Si>NaCl>干冰
D.HF>HCl>HBr>HI
参考答案:D
本题解析:A中属于金属晶体,在最外层电子数相同的条件下,离子半径越大,其熔沸点越低,正确;B是分子晶体,相对分子质量越大,熔沸点越高,正确。C中金刚石、晶体Si是原子晶体,原子半径越大,其熔沸点越低,正确;D也是分子晶体,但HF因分子间形成氢键,其熔沸点反常升高,故其顺序应为HF>HI>HBr>HCl,错误。
本题难度:简单
5、选择题 等电子原理认为:含有相同原子数和相同价电子数(指全部电子总数或价电子总数)的分子或离子,具有相同的结构特征.下面各组微粒中,几何构型不相同的是( )
A.H3O+、NH3
B.NH4+、CH4
C.NH3、BF3
D.CO2、BeCl2
参考答案:C
本题解析:
本题难度:一般