微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
[? ]
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛烧碱溶液的试剂瓶不能用玻璃塞,是为防止烧碱跟SiO2反应生成硅酸钠而使瓶塞与瓶口粘在一起
参考答案:B
本题解析:
本题难度:简单
2、填空题 工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。
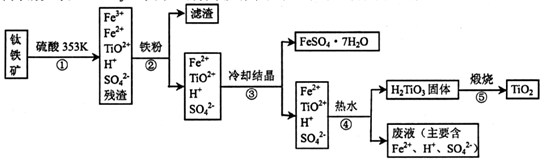
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异? b溶解性差异? c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为?
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。
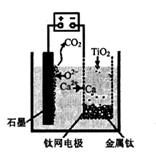
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
参考答案:
(1) 2Fe3++Fe=3Fe2+? (2分)?(2) b? (2分)?(3) 过滤? (2分)
(4) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O? (2分)
(5)① 2O2-—4e-+C=CO2↑? (2分)?
② 制备TiO2时,电解槽发生反应:2CaO 2Ca+O2↑,2Ca+ TiO2="Ti" +2CaO,可知CaO的总量不会变(3分)?(合理答案给分)
2Ca+O2↑,2Ca+ TiO2="Ti" +2CaO,可知CaO的总量不会变(3分)?(合理答案给分)
(6) 24%? (2分)
本题解析:(1)见答案(2)将FeSO4·7H2O从溶液中分离出来,利用了物质溶解性的差异(3)步骤②、③、④均是固液分离(4)废液中含有H+和Fe2+具有还原性,与MnO2发生氧化还原反应(5)由图可知,O2-在阳极放电,石墨电极参与反应生成了CO2
(6)Ti?~? TiO2
48? 80
m= 0.96t? 1.6t
则钛铁矿中钛元素的质量分数是0.96÷4.0×100%=24%
本题难度:一般
3、选择题 19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了 (? )
A.大量铝土矿
B.电解氧化铝制取铝的方法
C.用金属钠还原氧化铝的方法
D.无水氯化铝与钾制取铝的方法
参考答案:B
本题解析:金属铝比较活泼,不易还原,从矿石中很难到。金属铝的冶炼方法先进主要为点解氧化铝的方法。
本题难度:简单
4、选择题 能源可以划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源;需依靠其它的能源间接制取的能源称为二级能源。氢气是一种高效而且没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O=2H2+O2。
下列叙述正确的是
A.电能是一级能源
B.水力是二级能源
C.天然气是一级能源
D.焦炉气是一级能源
参考答案:C
本题解析:电能需要利用其他能源产生,属于二级能源。水利可以直接利用,是一级能源。煤的干馏产生煤焦油,是二级能源。所以正确的答案是C。
本题难度:简单
5、实验题 (16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为?。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是?。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是?;
②滴定终点的现象是?。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为?。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果?。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果?。
参考答案:(1) TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl(3分)
TiO2·xH2O↓+4HCl(3分)
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(2分)
(2)①抑制 NH4Fe(SO4)2水解(2分)?②溶液变成红色(2分)
③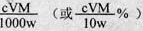 ?(3分)?④偏高(2分)?偏低(2分)
?(3分)?④偏高(2分)?偏低(2分)
本题解析:
⑴水解反应的化学方程式TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
③ω(TiO2)= ④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
本题难度:一般