微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,某溶液中由水电离出c(H+)=10-13 mol·L-1 ,该溶液可能是
[? ]
A.氯化铵水溶液
B.碳酸钠溶液
C.食盐水
D.稀硫酸
参考答案:B
本题解析:
本题难度:一般
2、选择题 对H2O的电离平衡不产生影响的粒子是
[? ]
A.
B.
C.
D.
参考答案:C
本题解析:
本题难度:一般
3、填空题 (7分)(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
_____________________________ ____
(2)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为2Li(s)+I2(s)==="2LiI(s)" ΔH
已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1 ②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
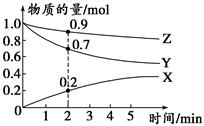
由此分析,该反应的化学方程式为______________ __________;
从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为 ,若加水稀释至1000L,则溶液的pH为 。
参考答案:(1)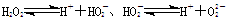 (2)1/2 (ΔH1-ΔH2)
(2)1/2 (ΔH1-ΔH2)
(3)3Y+Z 2X 0.025 mol·L-1·min-1 (4) 8 6
2X 0.025 mol·L-1·min-1 (4) 8 6
本题解析:(1)多元弱酸分步电离,若把H2O2看成是二元弱酸,电离方程式为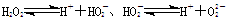 ;
;
(2)根据盖斯定律,2Li(s)+I2(s)==="2LiI(s)" ΔH=(①-②)÷2=(ΔH1-ΔH2)÷2;(3)根据2min时,XYZ的变化量为0.2mol、0.3mol、0.1mol,所以反应方程式为3Y+Z 2X ;
2X ; 0.025 mol·L-1·min-1 ;(4)0.01 mol·L-1的NaOH溶液c(OH-)=1×10-2 mol·L-1, pH=10,c(H+)=1×10-10 mol·L-1,在此温度下Kw=10-12 mol·L-1;1mL 0.1mol/L KOH溶液加水稀释至1L,c(OH-)=1×10-4 mol·L-1,c(H+)=1×10-8 mol·L-1,PH=8;若加水稀释至1000L,溶液接近中性,则溶液的pH为6。
0.025 mol·L-1·min-1 ;(4)0.01 mol·L-1的NaOH溶液c(OH-)=1×10-2 mol·L-1, pH=10,c(H+)=1×10-10 mol·L-1,在此温度下Kw=10-12 mol·L-1;1mL 0.1mol/L KOH溶液加水稀释至1L,c(OH-)=1×10-4 mol·L-1,c(H+)=1×10-8 mol·L-1,PH=8;若加水稀释至1000L,溶液接近中性,则溶液的pH为6。
考点:本题考查水的电离、溶液PH。
本题难度:一般
4、选择题 下列电离方程式正确的是( )
A.H2SO4=H2++SO42-
B.AlCl3=Al3++3Cl-
C.Ba(OH)2=Ba2++(OH)2-
D.HNO3=H++N5++3O2-
参考答案:B
本题解析:
本题难度:一般
5、选择题 纯水在10℃和100℃时的pH,前者和后者的关系是:
A.前者大
B.前者小
C.相等
D.不能确定