微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 软锰矿的主要成分是MnO2,工业上生产纯净的MnO2和金属锌主要涉及下面两个反应:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4 +2H2O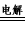 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列有关判断正确的是
[? ]
A.由反应①可知氧化性H2SO4>MnO2
B.反应①和反应②是可逆反应
C.①中析出16 gS时转移1 mol电子
D.反应②中Mn2+在阴极放电
参考答案:C
本题解析:
本题难度:一般
2、简答题 已知2A3++2B-═2A2++B2,C2+2A2+═2A3++2C-,2C-+D2═C2+2D-.现向含有A2+、B-、C-、D-的溶液中加入足量的C2,则反应后溶液中离子数明显减少的是______,基本不变的是______.
参考答案:2A3++2B-=2A2++B2中氧化性A3+大于B2,C2+2A2+═2A3++2C-中氧化性C2大于A3+,2C-+D2═C2+2D-中氧化性D2大于C2,所以氧化性大小顺序为:D2>C2>A3+>B2,
2A3++2B-=2A2++B2中还原性B-大于A2+,C2+2A2+═2A3++2C-中还原性A2+大于C-,2C-+D2═C2+2D-中还原性C-大于D-,所以还原性大小顺序为:B->A2+>C->D-,
在溶液中氧化性强的微粒与还原性强的微粒先发生反应,含有A2+、B-、C-、D-的溶液中加入足量的C2,由于氧化性C2>A3+>B2,所以C2能氧化A2+和B-,所以二者在溶液中明显减少,由于D-不反应则微粒数目基本不变,故答案为:A2+,B-; D-.
本题解析:
本题难度:一般
3、选择题 已知:X2、Y2、Z2、W2四种物质的氧化能力W2> Z2>X2>Y2,下列氧化还原反应能发生的是
[? ]
A、2NaW+Z2 = 2NaZ+W2
B、2NaX+Z2 = 2NaZ+X2
C、2NaY+W2 = 2NaW+Y2
D、2NaZ+X2 = 2NaX+Z2
参考答案:BC
本题解析:
本题难度:一般
4、选择题 下列判断中一定正确的是( )
A.若A2+2D-=2A-+D2,则还原性:D->A-
B.若R2-和M+的电子层结构相同,则原子序数:R>M
C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
参考答案:A、反应A2+2D-=2A-+D2中,D-是还原剂,是还原产物A-,原剂还原性强于还原产物的还原性,所以还原性D->A-,故A正确;
B、R2-和M+的电子层结构相同,M位于R的下一周期,原子序数M>R,故B错误;
C、若分子结构相似,分子间不存在氢键,相对分子质量越大,分子间作用力越强,氢化物的沸点越高.但Y的氢化物可能存在氢键,不能确定沸点高低,故C错误;
D、同主族自上而下非金属性减弱,M、N是同主族元素,原子序数:M>N,则非金属性:M<N,故D错误.
故选:A.
本题解析:
本题难度:简单
5、选择题 下列说法正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Cu2+、Fe3+、Zn2+的氧化性依次增强
参考答案:B
本题解析:A、铅蓄电池在放电过程中,负极生成硫酸铅固体附着在电极表面,电极质量增大,错误;B、根据△H - T△S>0 ,又知该反应△S>0 ,则该反应的△H>0 ,正确;C、使用催化剂能加快反应速率,但不能提高反应物的平衡转化率,错误;D、溶液中Cu2+、Fe3+、Zn2+的氧化性强弱顺序为Fe3+>Cu2+>Zn2+ ,错误。
本题难度:一般