微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积(大于25 mL),并检验Cl2的氧化性。
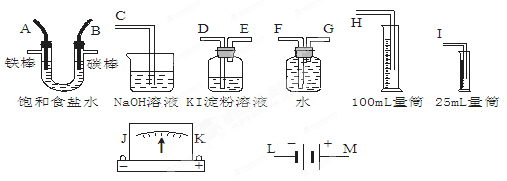
(1)A极发生的电极反应式是______________,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。(填气体接口字母)
参考答案:(1)阴极:2H++2e-=H2↑;阳极:2Cl-—2e-=Cl2↑(2)H F G D E C
本题解析:(1)若电解饱和NaCl溶液来测定产生的H2的体积并检验Cl2的氧化性。则应该使A与电源的负极连接,作阴极,在该电极上发生反应:2H++2e-=H2↑;B与电源的正极连接,作阳极,该电极发生的电极反应是:2Cl-—2e-=Cl2↑;(2)设计上述气体实验装置时,由于产生的H2的体积大于25 mL,所以应该选择100ml的量筒,各接口的正确连接顺序为H接F、G接A、B接D、E接C。
本题难度:一般
2、选择题 下列说法正确的是(?)
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3 mol Cl2转移电子数为6NA
C.SiO2与烧碱反应只生成盐和水,属于酸性氧化物
D.Cl2的水溶液具有酸性,Cl2通入紫色石蕊溶液中,溶液只变红
参考答案:C
本题解析:A、看具体反映,在氯气与水的反应中就只转移了NA,错误;B、转移电子5NA,错误;C、正确;D、如果量少,也可能是紫色,错误。
本题难度:一般
3、计算题 (6分)将10g NaCl和NaI的混合物溶于水后,通入足量的Cl2,将溶液蒸干灼烧得固体6.34g. 求原混合物中NaCl的质量分数。
参考答案:40%
本题解析:考查根据反应式进行的应该计算。
氯气能把碘化钠中碘离子氧化生成单质碘,由于碘单质易挥发,所以在最终得到的固体全部是氯化钠,则
CI2+2NaI=I2 +2NaCl?△m
2×150g? 2×58.5g? 183g
m?(10g-6.34g)?
所以有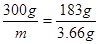
解得m=6g
因此原混合物中NaCl的质量分数为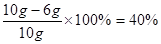
本题难度:一般
4、实验题 某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。

(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:____________________________________。
参考答案:(1)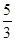
(2)B中长颈漏斗中液面上升,形成液柱
(3)无水氯化钙(硅胶、P2O5)、干燥的有色布条
(4)打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘
(5)Cl2+2NaOH=NaCl+NaClO+H2O
(6)SO32-+Cl2+H2O=SO42-+2Cl-+2H+、SO32-+2H+=SO2↑+H2O
本题解析:(1)KClO3与浓盐酸发生反应:KClO3+6HCl=3Cl2+KCl+3H2O,由氧化还原反应可知,生成3 mol Cl2,转移5 mol电子,因此当产生1 mol Cl2时,转移电子的物质的量为5/3 mol。(2)若装置C发生堵塞,则B内压强变大,导致B中长颈漏斗中液面上升,形成液柱。(3)为做对比,看干燥的氯气是否具有漂白性,Ⅱ处应放吸水剂,Ⅲ处放干燥的有色布条。
点拨:本题考查物质的制备与性质验证实验等,考查考生的实验能力。难度中等。
本题难度:一般
5、填空题 做过碘升华实验的烧杯壁上残留的碘可用?洗涤除去;原盛 溶液的
溶液的 试剂瓶壁褐色斑点应用?洗涤除去;检验
试剂瓶壁褐色斑点应用?洗涤除去;检验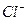 存在的试剂是?.
存在的试剂是?.
参考答案:酒精;浓盐酸;稀硝酸酸化的AgNO3
本题解析:略
本题难度:简单