|
高考化学知识点总结《二氧化硫》试题强化练习(2017年最新版)(八)
2017-07-18 02:31:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如右图所示,在注射器中加入少量Na2SO3,晶体,并吸人少量的浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
A.湿润蓝色石蕊试纸先变红后褪色
B.蘸有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.湿润品红试纸褪色,证明了SO2的漂白性
D.蘸有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
| 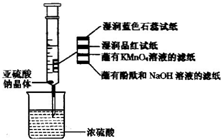
参考答案:A.SO2只能使酸碱指示剂变色,所以湿润的蓝色石蕊试纸只变红,故A错误;
B.SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应,KMnO4溶液的滤纸褪色,故B错误;
C.湿润品红试纸褪色,表现出SO2的漂白性,故C正确;
D.SO2为酸性气体,可与NaOH溶液反应生成盐和水,溶液碱性减弱,红色褪去,没有体现SO2的漂白性,故D错误;
故选C.
本题解析:
本题难度:一般
2、简答题 测定转化成SO3的转化率可以用如图装置,装置中烧瓶内发生的化学反应方程式为:
Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知S03的熔点是16.8℃,沸点是44.8℃)

(1)装置中甲管的作用是______.
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从题图A?E装置中选择最适合装置并将其序号填放下面的空格中.I、II、III、IV处连接的装置分别是______
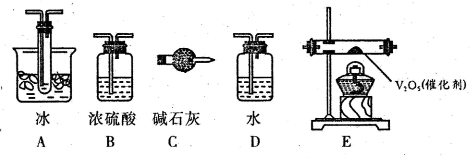
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是______,若用大火加热烧瓶时,SO2的转化率会______?(填“升高”、“不变”或“降低”).
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______②原因:______?③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为______
(6)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2-段时间后,测得装置IV增重了?mg,则实验中SO2的转化率为______.(用含m、n的代数式填写)
参考答案:(1)由图可知,液体流下时使分液漏斗中压强减小,不利于液体流下,而甲装置能保证分液漏斗和烧瓶内气体压强相等,则甲能使液体顺利流下,故答案为:让硫酸顺利滴下;
(2)因从溶液中反应生成气体中混有水蒸气,则I处应选择B装置来吸收水进行气体的干燥,II中选E进行二氧化硫气体的催化氧化,S03的熔点是16.8℃,沸点是44.8℃,III中选A进行冷却,使三氧化硫与二氧化硫分离,在IV中选择C装置来吸收未反应的SO2,故答案为:BEAC;
(3)因催化剂在一定的温度下催化效果好,则应先加热催化剂,大火加热时反应速率过快,生成的部分二氧化硫未反应就通过了E装置,导致SO2的转化率降低,
故答案为:先加热催化剂再滴入浓硫酸;降低;
(4)SO2气体产生缓慢,可能为Na2SO3变质生成硫酸钠,也可能为浓硫酸的浓度不够,反应速率变慢,故答案为:Na2SO3变质;浓硫酸的浓度不够;
(5)SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,有6.02×1023个电子转移,则Cl元素的化合价由+5价降低为+4价,由质量守恒定律可知反应的化学方程式为
SO2+2HClO3═H2SO4+2ClO2,故答案为:SO2+2HClO3═H2SO4+2ClO2;
(6)IV增重了mg,为未反应的SO2的质量,其物质的量为m64mol,nmolNa2SO3粉末与足量浓硫酸反应生成nmolSO2,则转化率为n-m64n×100%=64n-m64n×100%,
故答案为:64n-m64n×100%.
本题解析:
本题难度:一般
3、选择题 检验SO2中是否混有CO2气体,可采用的方法是( ? )
A.通过品红溶液
B.先通过NaOH溶液,再通过澄清石灰水
C.通过澄清石灰水
D.先通过KMnO4酸性溶液,再通过澄清石灰水
参考答案:D
本题解析:
本题难度:简单
4、选择题 飘尘是物质燃烧时产生的粒状飘浮物,颗粒很小,不易沉降,它与空气中SO2、O2接触时,SO2会部分转 化为SO3,使空气的酸度增加,飘尘所起的作用可能是
[? ]
A.氧化剂
B.还原剂
C.催化剂
D.吸附剂
参考答案:CD
本题解析:
本题难度:一般
5、填空题 如图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图.往试管Ⅰ中加入一小块铜片,再加入3~5mL?浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管Ⅱ的溶液中.
(1)若试管Ⅱ中的溶液是紫色石蕊试液,反应一段时间后,试管Ⅱ中看到的现象是______.
(2)若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是______,反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是______.
(3)实验过程中,试管Ⅱ管口塞一团浸有NaOH溶液的棉花,作用是______,有关反应的离子方程式为______.
参考答案:铜和浓硫酸在加热条件下能发生生成硫酸铜和二氧化硫、水.
(1)二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液呈酸性,紫色石蕊试液遇酸变红色,所以溶液呈红色.
故答案为:溶液呈红色.
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色.
故答案为:品红溶液褪色;溶液恢复红色.
(3)二氧化硫有毒,所以不能直接排空,二氧化硫是酸性氧化物,能和碱反应生成盐和水,所以试管Ⅱ管口塞一团浸有NaOH溶液的棉花的作用是吸收未反应的SO2气体,离子方程式为SO2+2OH-=SO32-+H2O.
故答案为:吸收未反应的SO2气体;?SO2+2OH-=SO32-+H2O.
本题解析:
本题难度:一般
| 