| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《物质的量》高频考点预测(2017年最新版)(四)
参考答案:D 本题解析:质量的单位为g,不是g/mol,故A项错误;应用气体体积需注明条件,不注明条件22.4L H2的物质的量不一定是是1mol,故B项错误;将80gNaOH溶于1L水中,溶剂水的体积是1L,但溶液体积不一定是1L,故所得溶液中NaOH的物质的量浓度不是2mol/L,故C项错误;NaCl的摩尔质量数值上等于其相对分子量,故是58.5g/mol,故D项正确。 本题难度:一般 2、选择题 在标准状况下,与12 g H2的体积相等的N2的( ) |
参考答案:B
本题解析:在标准状况下,任何气体的摩尔体积约22.4 L·mol-1,体积相等时,气体的物质的量也相等。12 g H2的物质的量是6 mol,因此氮气的物质的量是6 mol。6 mol N2的质量:6 mol×28 g·mol-1="168" g,6 mol H2或6 mol N2在标准状况下的体积约为22.4 L·mol-1×6 mol="134.4" L。
本题难度:一般
3、填空题 (1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式:?。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为??g。
参考答案:(4分)(1)CaCO3(s)=CaO(s) +? CO2(g)?ΔH=+175.6kJ·mol-1?(2)4.16
本题解析:(1)10g CaCO3分解需要吸收17.56kJ 热量,则1mol即100g碳酸钙分解需要消耗的能量是175.6kJ,因此该反应的热化学方程式是CaCO3(s)=CaO(s) +? CO2(g)?ΔH=+175.6kJ·mol-1。
(2)碳酸氢钠分解的方程式是2NaHCO3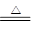 Na2CO3+H2O+CO2↑?△m↓
Na2CO3+H2O+CO2↑?△m↓
2×84g? 106g? 62g
m? 0.31g
解得m=(62g×0.31g)÷168g=0.84g
所以原混合物中碳酸钠的质量为5.00g-0.84g=4.16g
点评:该题是基础性试题的考查,难度不大,有利于培养学生规范的答题能力,在计算碳酸钠的质量时,注意利用好差量法,注意有关解题方法的归纳和总结。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )
A.常温下,23 g NO2含有NA个氧原子
B.1 L 0.1 mol·L-1氨水含有0.1 NA个OH-
C.常温常压下,22.4 L CCl4含有NA个CCl4分子
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
参考答案:A
本题解析:23gNO2的物质的量是23g÷46g/mol=0.5mol,含有1mol氧原子,A正确;B不正确因为氨水是弱碱,部分电离,即.1 L 0.1 mol·L-1氨水含有OH-个数小于0.1 NA;常温常压下四氯化碳不是气体,不能适用于气体摩尔体积,C不正确;D不正确,反应中亚铁离子失去1个电子,答案选A。
点评:阿伏加德罗常数是历年高考的“热点”问题,因为它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
5、选择题 某V ml Al2(SO4) 3溶液中含a g Al3+,取出V/4 ml溶液稀释成 4V ml,则稀释后溶液的SO42-的物质的量浓度是( )
A.125a/9V mol/L
B.125a/18V mol/L
C.125a/36V mol/L
D.125a/54V mol/L[来源:91考试网]
参考答案:C
本题解析:
正确答案:C
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《燃烧热》考.. | |