微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
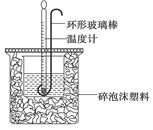
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值: (填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g) 2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
化学键
| H—H
| N—H
| N≡N
|
键能kJ·mol-1
| 436
| 391
| 945
|
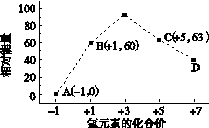
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO3-(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
参考答案:(1)①保温(或隔热、或减少热量损失) ②偏小
③HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1
(2)①CH4(g)+2H2O(g)=== CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1 ② -93 ③ -117
本题解析:(1)①中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;②大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会偏小;③由实验可知反应生成0.025moL水时,产生的热量为1.42kJ,则该反应的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1;
(2)①根据盖斯定律,CH4(g)+2H2O(g)="==" CO2(g)+ 4H2(g)的ΔH=2×(+206.2 kJ·mol-1)-(+247.4 kJ·mol-1)=+165kJ·mol-1,所以CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:CH4(g)+2H2O(g)="==" CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1;②根据ΔH=反应物的总键能-生成物的总键能,得N2(g)+3H2(g) 2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得ΔH=63-3×60=-117kJ/mol。
2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得ΔH=63-3×60=-117kJ/mol。
考点:考查中和热的测定,热化学方程式的书写,盖斯定律的应用。
本题难度:一般
2、选择题 下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水
B.加热氯酸钾使其分解
C.碘升华
D.氯化钠熔化
参考答案:A、氯化氢是共价化合物溶于水电离成氯离子和氢离子,破坏了共价键,故A不符合;
B、氯酸钾分解生成了氧气和氯化钾,旧化学键断裂,新化学键形成,故B不符合;
C、碘升华是碘分子间的距离增大直接变成气体的过程,是物理过程,不需破坏化学键,故C符合;
D、氯化钠熔化破坏了离子键,故D不符合;
故选C.
本题解析:
本题难度:一般
3、选择题 从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.Cl2溶于水
B.碘升华
C.氯化钠受热熔化
D.酒精溶解于水
参考答案:A、氯气溶于水发生了化学反应,氯气和水反应生成盐酸和次氯酸,所以既有旧化学键的断裂,又有新化学键的形成,故A正确.
B、碘升华是物理变化,只是物质的状态发生了变化,没有发生化学反应,所以没有旧化学键的断裂和新化学键的形成,故B错误.
C、氯化钠受热熔化是物理变化,只是物质的状态发生了变化,没有发生化学反应,故C错误.
D、酒精溶于水没有发生化学反应,所以没有旧化学键的断裂和新化学键的形成,故D错误.
故选A.
本题解析:
本题难度:简单
4、填空题 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 。
(2)已知H2O(l) H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
肼和二氧化氮反应的热化学方程式为 。
参考答案: (1)N2H4(l)+2H2O2(l) N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
(2)408.815
(3)产物不会造成环境污染
(4)N2H4(g)+NO2(g) 3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
本题解析: (1)0.4 mol N2H4反应放热256.652 kJ,则1 mol N2H4反应放热kJ=641.63 kJ。
(2)16 g N2H4的n(N2H4)==0.5 mol。由方程式知生成n(H2O)=0.5 mol×4="2" mol,则16 g N2H4与H2O2生成H2O(l)放热为641.63 kJ×0.5 mol+2 mol×44 kJ·mol-1=408.815 kJ。
(3)产物为N2(g)和H2O,无污染。
(4)由所提供方程式,利用盖斯定律求解。
考点:化学反应热的计算
本题难度:一般
5、填空题 写出下列物质的电子式(4分)
H2O? 1??KOH? 2??
CO2:? 3??Na2O2:? 4?
参考答案:1?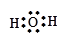 ?2?
?2? ?3?
?3?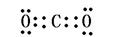 ?4?
?4?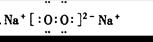
本题解析:1、为共价化合物,把元素最外层电子标出,共用电子对写在原子之间。2、离子化合物,注意有两个化学键,共价键和离子键。3、二氧化碳为共价化合物,碳和氧之间有两对共用电子对。4、过氧化钠的写法中,难点在于把过氧根离子写好。
点评:本题涉及到了常见物质的电子式的书写,离子化合物的电子式的书写注意阳离子的电子式为阳离子本身,而阴离子需要标出最外层所有的电子并打括号,带上电荷。共价化合物的电子式不带电荷,不打括号。
本题难度:一般